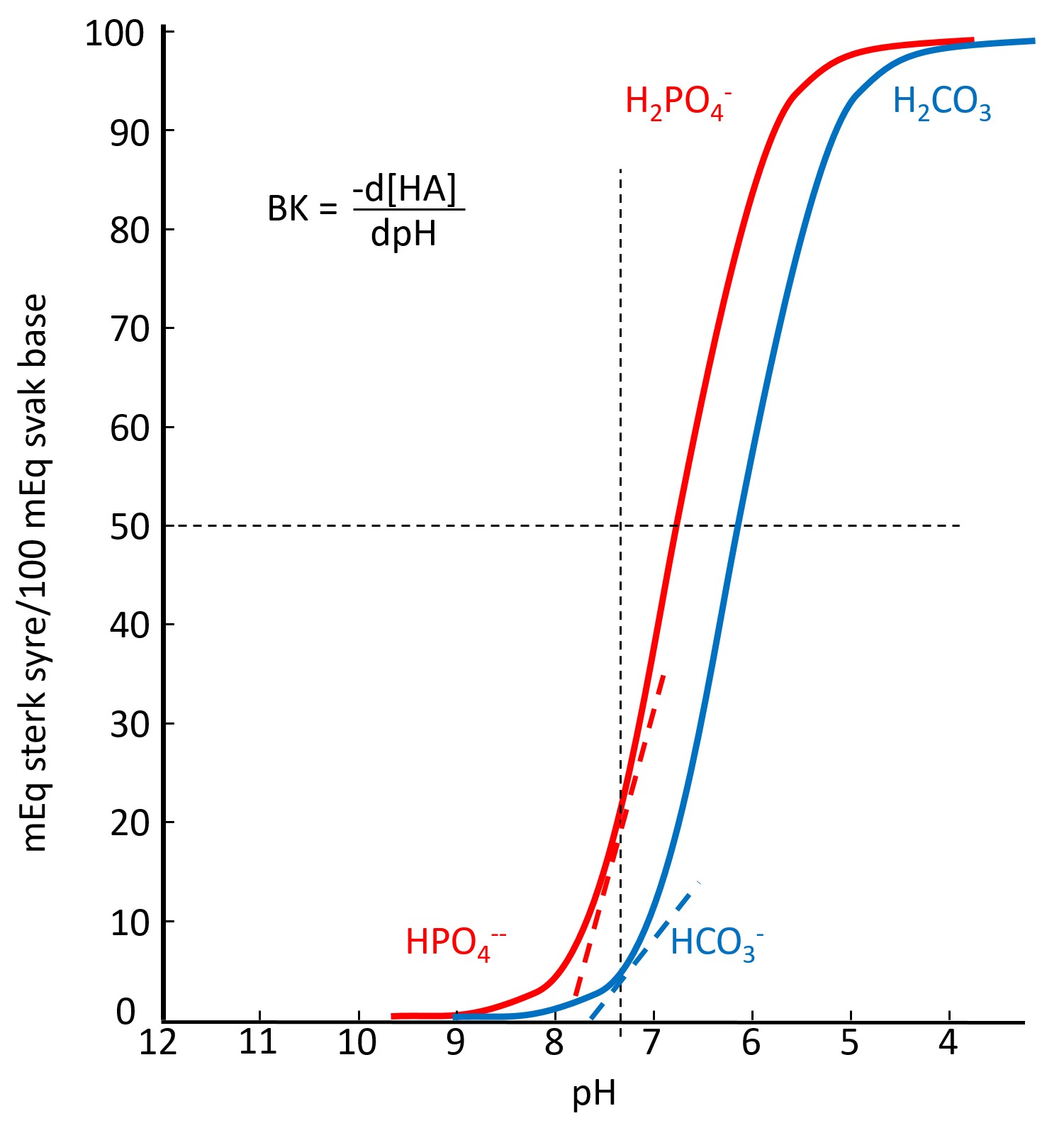
Hvis vi setter 1 ml 0,1 N saltsyre til 99 ml rent vann (pH = 7,0), slik at konsentrasjonen av H+ blir 0,001 mol/l, vil pH synke til 3,0. Hvis vi på forhånd hadde løst opp NaH2PO4 og Na2HPO4 i vannet slik at forholdet mellom [Na2HPO4] og [NaH2PO4] er 1.0 og summen av [Na2HPO4] og [NaH2PO4] er 1 mmol/l, ville pH i løsningen fortsatt være 7,0. Hvis vi nå setter til 1 ml 0,1 N saltsyre, vil pH bare synke til 6,0. Vi sier at fosfationene i vannet utgjør en buffer. Det som skjer er at HPO42- ionene tar opp en stor del av de tilsatte H+ ionene og blir til H2PO4-. Vi kaller de to fosfationene for et bufferpar.
Bufferkapasiteten (BK) til en løsning er definert som

De kjemiske reaksjonene som foregår inne i cellene og i vevsvæske og blod utenfor cellene, er svært følsomme for selv små pH-endringer vekk fra pH = 7,4. Årsaken er at en avikende H+-konsentrasjon vil endre "protoniseringen" av negative ladninger på proteiner (inklusive enzymer) – og derved endre deres struktur og funksjon. Organismen har derfor forsvarsmekanismer på tre nivåer som bidrar til å holde pH nær 7,4:
De tre mekanismene har ulik reaksjonstid på en rask syre- eller baseforstyrrelse. Buffervirkningene inntrer så fort løsningene (f.eks. blodet) er blandet (dvs. øyeblikkelig). Selv om bufferkapasiteten er stor er den statisk, dvs, kan ikke økes slik som CO2- bikarbonatsystemet. Respirasjonsreguleringen kommer raskt (i løpet av minutter), men trenger timer for å bli optimal. Nyrenes utskillelse av syre eller base tar flere timer for å endres – og dager for å bli fullstendig .
Blod inneholder mange buffersystemer, blant annet hemoglobin, andre proteiner (albumin), fosfater og CO2 – bikarbonat. Det siste systemet er spesielt viktig, både fordi bufferkapasiteten av bikarbonatsystemet i blod (og vevsvæsker) er stor, og fordi to av komponentene (CO2 og HCO3-) blir aktivt regulert ved fysiologiske mekanismer. (Den anbefalte betegnelsen på bikarbonat er nå hydrogenkarbonat, men bikarbonat er fortsatt mest brukt i medisinsk 'dagligtale').
Reaksjonslikningene for bikarbonatsystemet kan skrives:
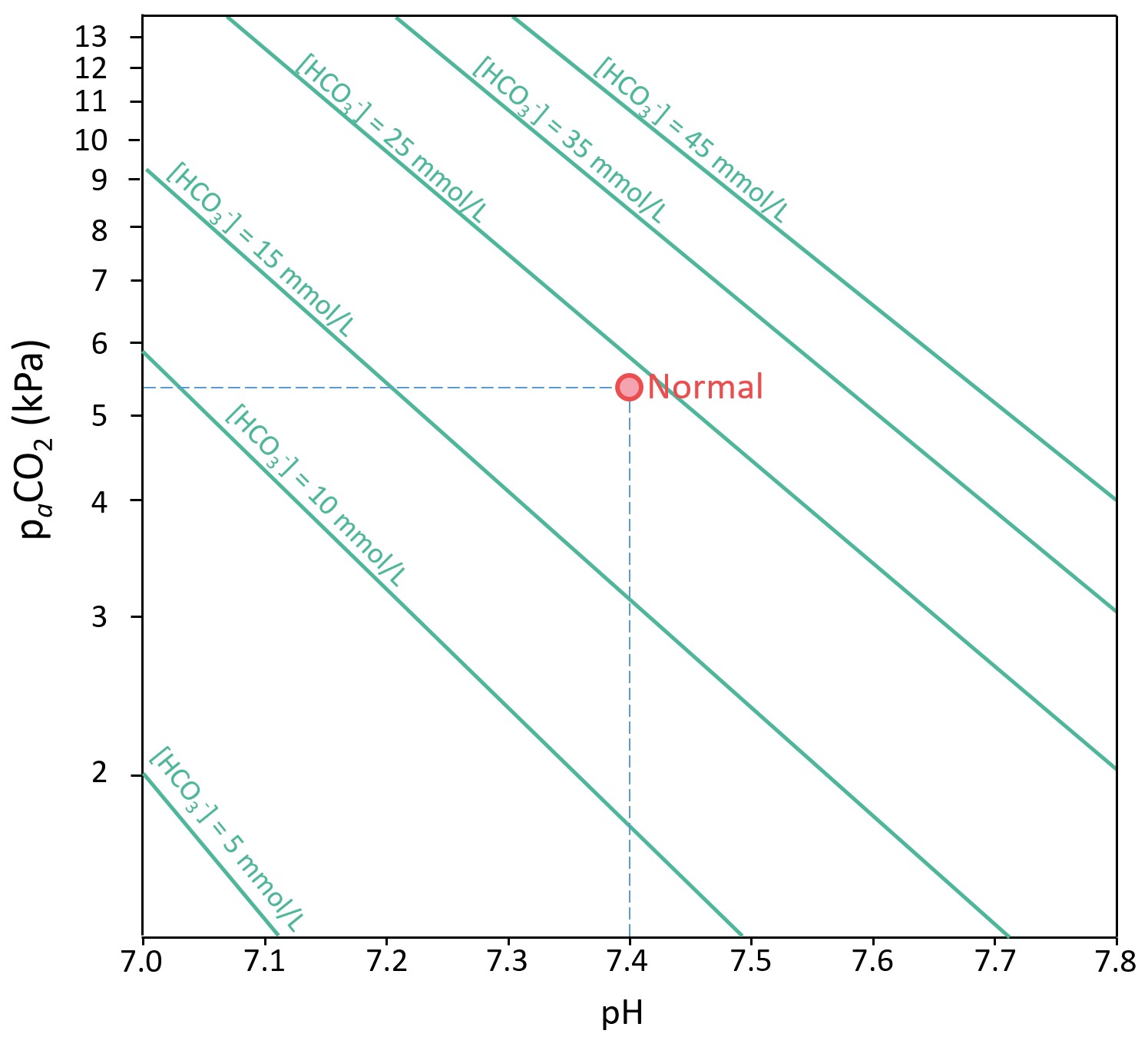
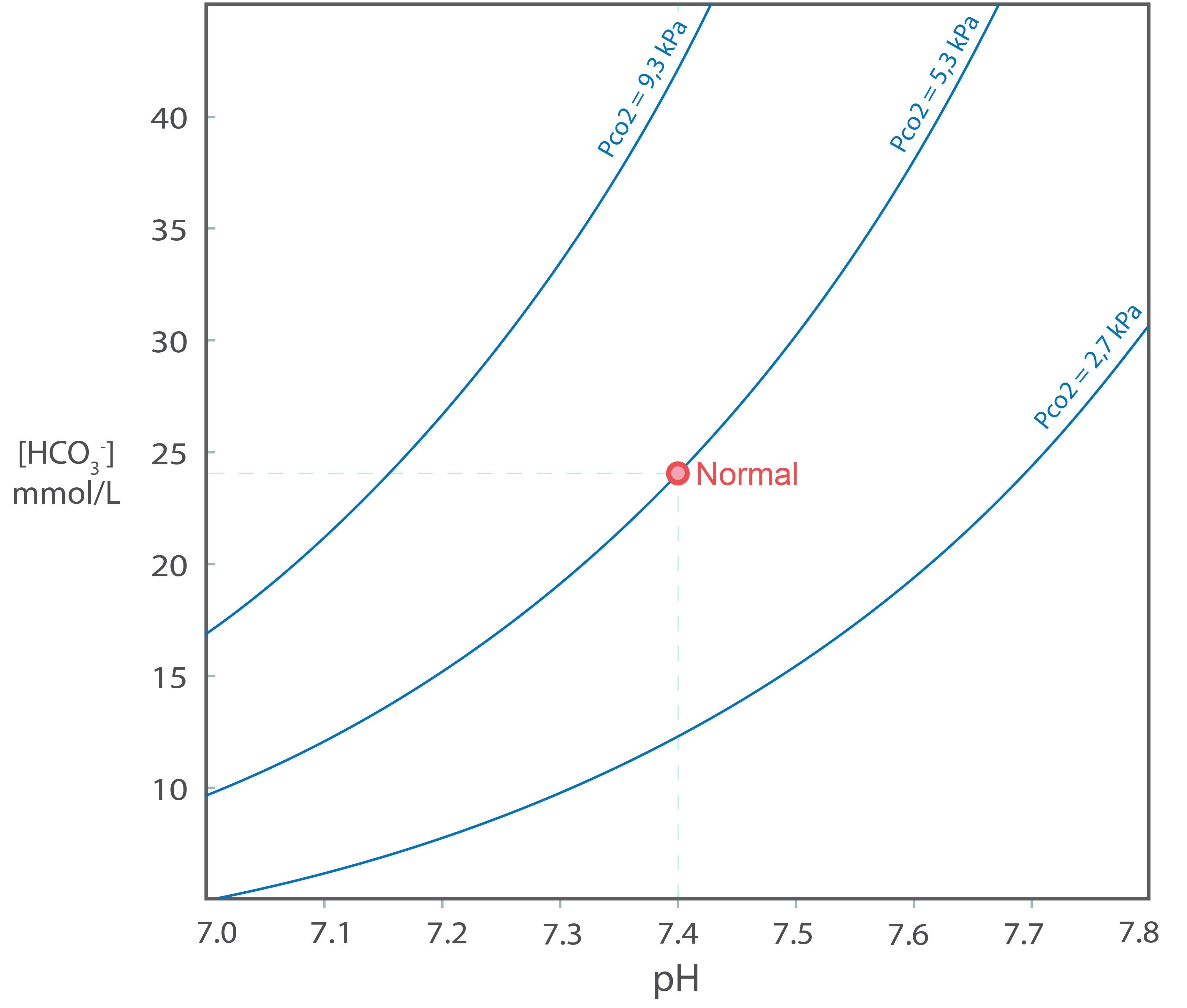 I en alternativ grafisk framstilling avsettes pH langs x-aksen, men pCO2 avsettes på y-aksen langs en logaritmisk skala. Iso-[HCO3-] linjer blir da rette linjer. Vi velger å kalle denne framstillingen Astrup diagrammet etter den danske legen Poul Astrup som utviklet det under arbeid med assistert ventilasjon av polio-pasienter under utbruddet i København i 1952-3. Det er basis for det klinisk mye brukte Siggaard-Andersen diagrammet som omtales senere.
I en alternativ grafisk framstilling avsettes pH langs x-aksen, men pCO2 avsettes på y-aksen langs en logaritmisk skala. Iso-[HCO3-] linjer blir da rette linjer. Vi velger å kalle denne framstillingen Astrup diagrammet etter den danske legen Poul Astrup som utviklet det under arbeid med assistert ventilasjon av polio-pasienter under utbruddet i København i 1952-3. Det er basis for det klinisk mye brukte Siggaard-Andersen diagrammet som omtales senere.
Det originale Davenportdiagrammet er kanskje best egnet til å forstå de fysiologiske mekanismene som er involvert under utviklingen av en syre-base forstyrrelse, mens diagrammet som Siggaard-Andersen laget, har fordeler i forhold til terapeutisk intervensjon.
I resten av kapitlet Fysiologi kommer vi til å bruke Davenport diagrammet for å illustrere prosessene. I tillegg er det viktig at studentene er fortrolige med reaksjonslikningen (1) og Henderson-Hasselbalchs likning (2). Vi kommer stadig til å referere til disse to likningene.
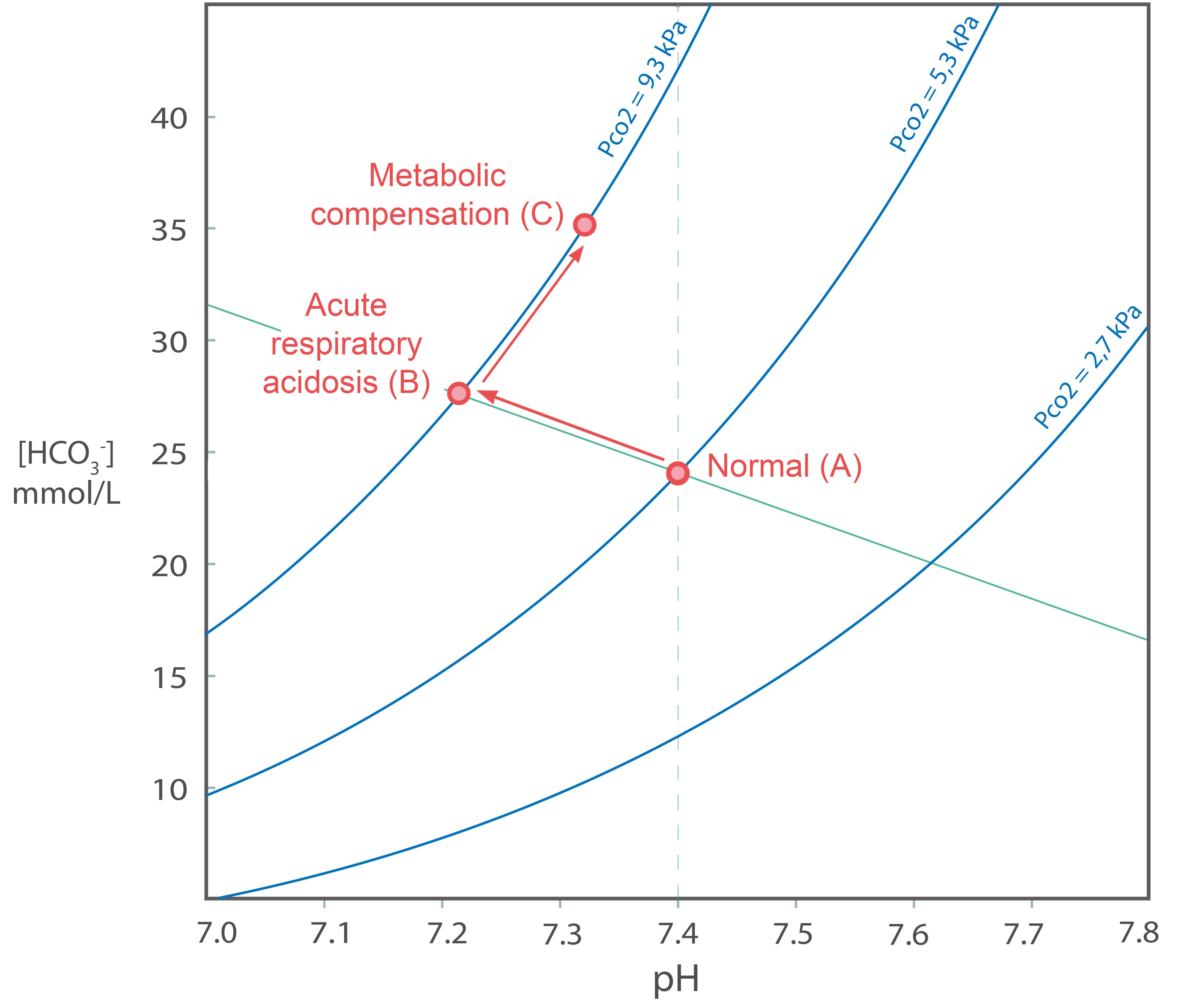
La oss først se på en pasient som har fått en overdose av morfin eller et annet opiat. Opiater virker hemmende på respirasjonssenteret i den forlengende marg, og pasienten vil derfor puste mindre enn normalt. I reaksjonslikningen
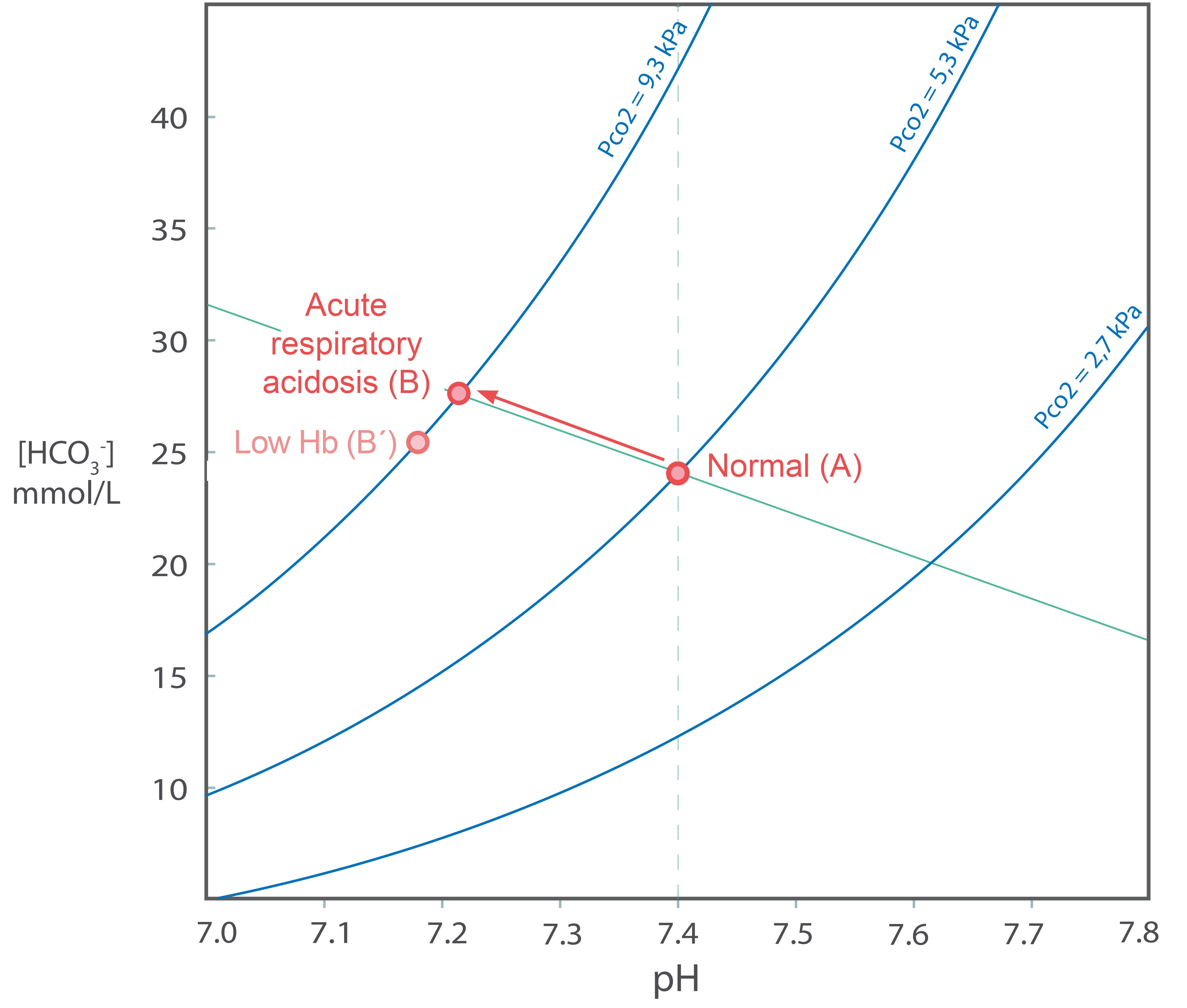
Etter en tid vil en akutt respiratorisk acidose kompenseres av fysiologiske mekanismer. Nyrene vil øke sin utskillelse av H+ ioner, samtidig som reabsopsjonen av bikarbonat vil øke noe. (Se et senere avsnitt om nyrenes behandling av H+ og [HCO3- ].). Mengden som skilles ut er avhengig av pH i arterielt blod til nyrene. Denne prosessen tar lang tid (fra timer til dager), men kan bringe pH nesten tilbake til normalverdien 7,4. Under utskillelsen i nyrene vil [H+] i reaksjonslikningen (1) falle og likevekten vil forskyves mot høyre. [HCO3- ] vil derfor stige. I Davenport-diagrammet vil vi bevege oss fra B til C langs en paCO2 isobar (hvis respirasjonen ikke endres). Tilstanden kalles en nær fullstendig renalt kompensert respiratorisk acidose. Pasienter med en kronisk respirasjonssvikt som har utviklet seg langsomt (f.eks. KOLS) kan ha svært høye paCO2 og [HCO3-] –verdier, men nær normal pH. I Davenport-diagrammet har slike pasienter over tid beveget seg direkte fra A til C.
 Vis blodgassverdier
Vis blodgassverdier
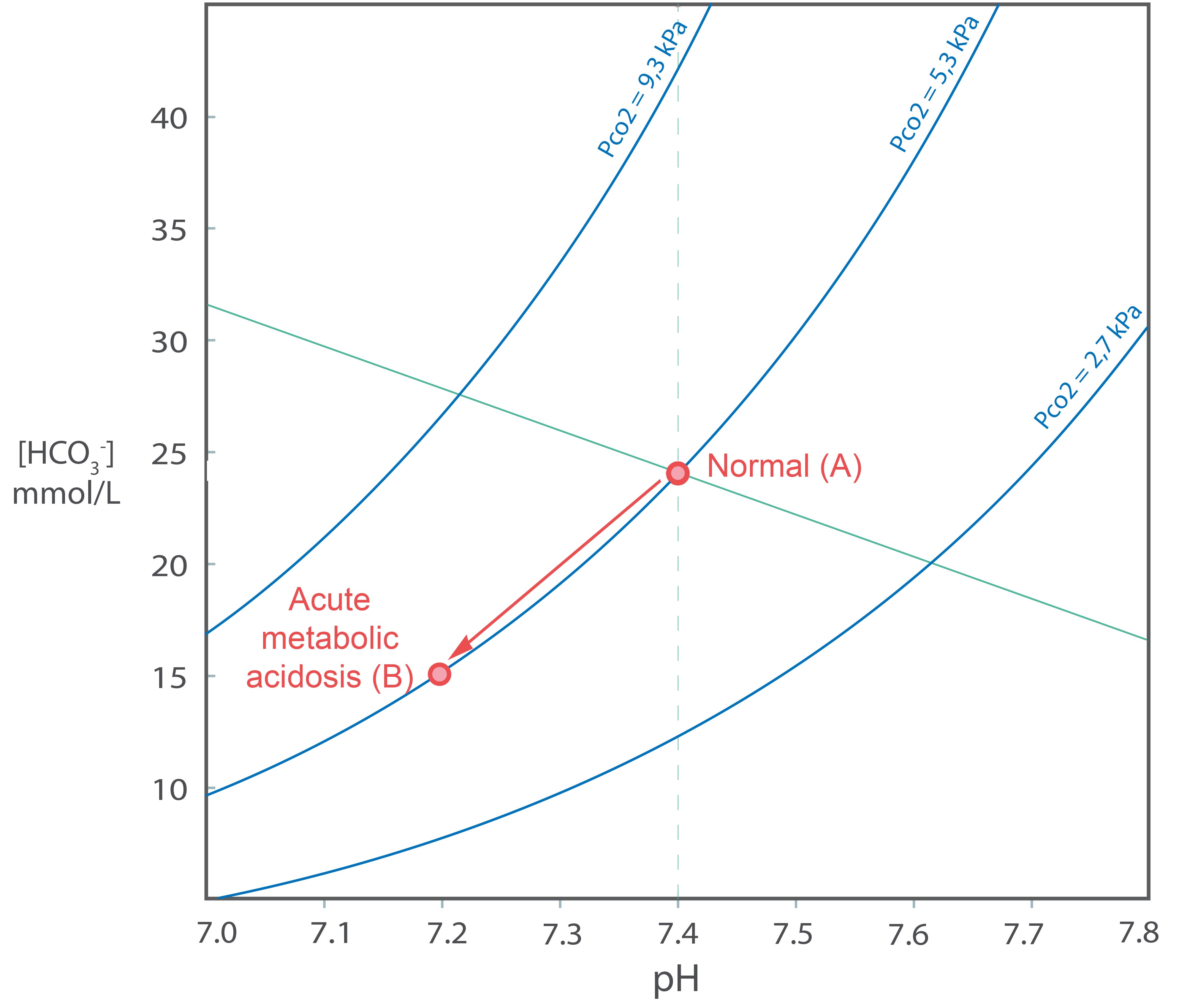
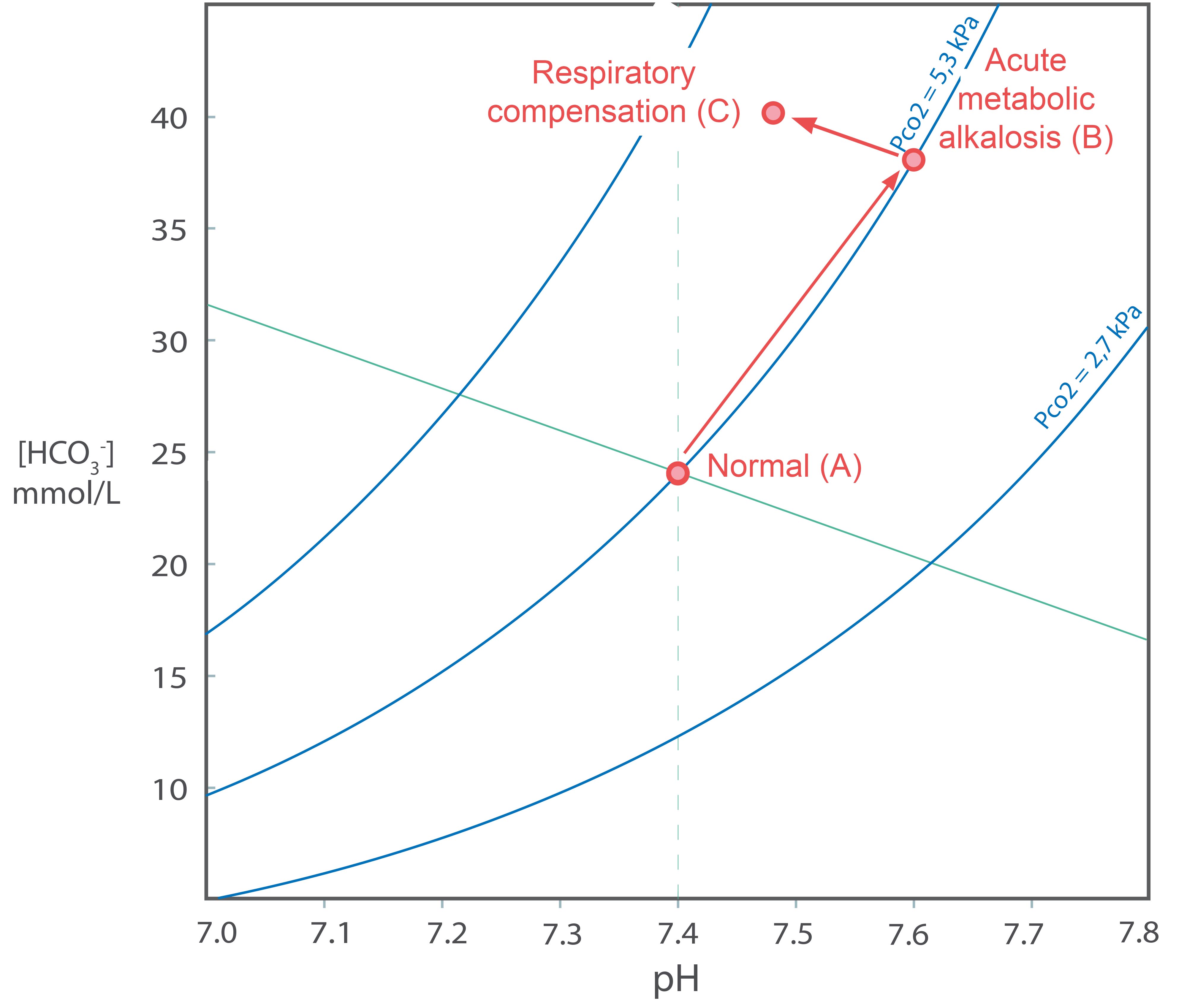
Vi går tilbake til normaltilstanden og tenker oss en situasjon der blodet til en pasient blir tilført noe syre, men at ventilasjonen ikke endres (d.v.s. paCO2 holdes konstant). Dette er en kunstig situasjon, men kan skje eksperimentelt på et forsøksdyr eller hos en pasient på en respirator. I reaksjonslikningen (1) vil [H+] gå opp (pH vil synke), likevekten forskyves mot venstre og [HCO3- ] vil gå ned. paCO2 vil ikke endres vesentlig, fordi det antall molekyler CO2 som forskyves til venstre side av (1) er svært lite sammenliknet med antall CO2 molekyler som blodet transporterer fra vev til lunger. I Davenport-diagrammet vil vi bevege oss nedover og til venstre langs en paCO2 isobar (fra A til B). Denne tilstanden kalles en akutt metabolsk acidose. I ren form vil vi ikke finne den annet enn i svært spesielle situasjoner.
Hva vil skje hvis vi lar forsøksdyret regulere sin egen ventilasjon, etter at det først har utviklet en akutt metabolsk acidose?
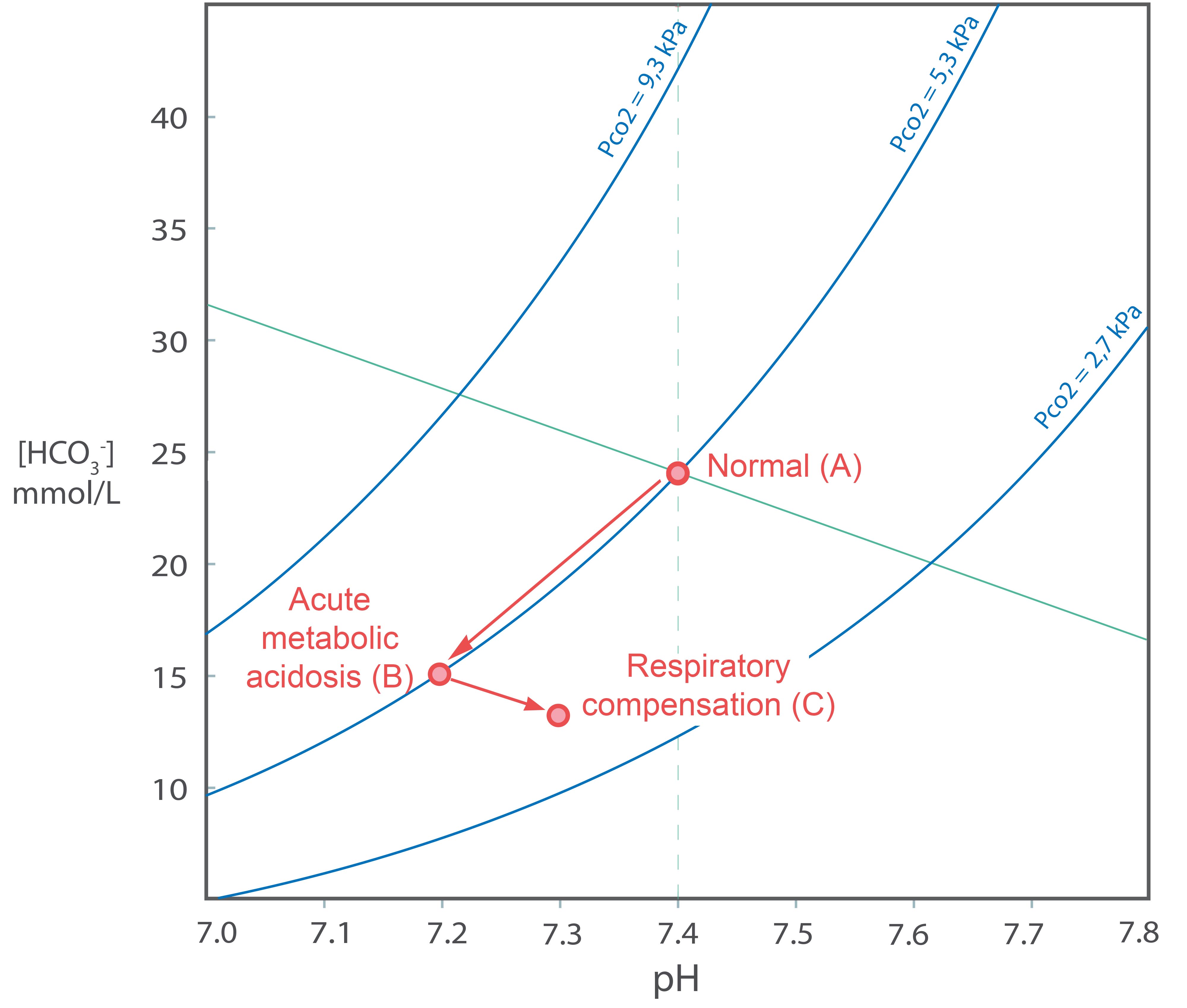
I punktet B ovenfor vil paCO2 være normal (5,3 kPa), men pH vil være lav (pH = 7,2), Den lave pH vil stimulere ventilasjonen og CO2 vil blåses av. I likning (1) vil CO2 minke og likevekten vil forskyves ytterligere mot venstre. [H+] vil gå ned, d.v.s. pH går opp, og [HCO3- ] går ned. I Davenport-diagrammet vil vi bevege oss nedover og til høyre langs en rett linje f.eks. til punktet C. Denne rette linjen vil være tilnærmet parallell med bufferlinjen (se ovenfor), men ha litt lavere vinkelkoeffisient fordi den totale bufferkapasiteten er litt lavere enn når [HCO3- ] er normal. Tilstanden C kaller vi en respiratorisk kompensert metabolsk acidose.
Her er det kanskje nødvendig å repetere litt respirasjonsfysiologi. I hvile kan ventilasjonen være styrt av tre variabler i arterielt blod: paO2, paCO2 og pH. Så lenge paO2 er høyere enn ca 8kPa, vil denne variabelen ikke påvirke ventilasjonen. Ventilasjonen øker med økende paCO2 og øker med fallende pH, og effekten av endringene vil være tilnærmet additive. Den respiratoriske kompensasjonen av en metabolsk acidose kan ikke bringe pH helt ned til 7,4. Hvis den hadde gjort det, ville pH vært normal, men paCO2 for lav til å kunne opprettholde en ventilasjon som må være litt høyere enn sammenliknet med normaltilstanden.
 Vis blodgassverdier
Vis blodgassverdier
En variabel som har vist seg å være nyttig ved vurdering av pasienter med metabolske syre-base forstyrrelser, er anion gap. Den opprinnelige definisjonen av anion gap var
$AG = [Na^+] – ([Cl^-] + [HCO_3^-])$
En nyere definisjon er
$AG = [Na^+] + [K^+] – ([Cl^-] + [HCO_3^-])$
Begge definisjonene er fortsatt i klinisk bruk. Normalområdet er selvfølgelig litt forskjellig avhengig av hvilken definisjon som brukes. I Norge brukes den nyeste. Normalverdien for denne siste er nær 12 (4-20) mmol/l når ionene måles i plasma.
Her må vi presisere at det selvfølgelig aldri mangler noen anioner i serum eller i andre kroppsvæsker. Summen av positive ladninger er lik summen av negative ladninger og væsken er elektrisk nøytral. Hovedmengden av de negative ladningene som tilsynelatende mangler i ligningen ovenfor, og som kalles anion gap, sitter på plasmaproteiner i ikke-patologiske situasjoner. I patologiske tilstander kan andre organiske ioner med negative ladninger erstatte [HCO3-], f.eks. HCOO- (maursyre) ved metanolforgiftning, og AG øker.
La oss så ta for oss en ikke sjelden klinisk tilstand, som dere kommer til å få høre mer om senere i studiet: metanolforgiftning. Alkohol i øl, vin og brennevin heter etanol i kjemisk terminologi, og har kjemisk formel CH3CH2OH. Metanol har formelen CH3OH. Både etanol og metanol kan selges illegalt om hverandre og smaken er ikke svært forskjellig, og kan derfor forveksles av misbrukere. Etanol brytes ned i leveren av alkohol dehydrogenase til acetaldehyd og eddiksyre, dvs. det går inn i sitronsyrecyklus. Metanol brytes ned av det samme enzymet i lever til formaldehyd og maursyre HCOOH (se figur i Klinikkapitlet). Dette stoffet (anionet COOH-) er i seg selv toksisk i tillegg til å være anionet til en sterk syre (pKa 3,75). Organismen vil kvitte seg med maursyren via metabolisme i leveren, men dette går tregt hos primater på grunn av lave folatverdier. Noe maursyre vil også filtreres i nyrene og skilles ut i urinen, men dette tar også lang tid. I mellomtiden vil fortsatt metabolisme av metanol til maursyre gi en økende metabolsk acidose. Den respiratoriske kompensasjonen trer da gradvis inn, og i Davenport-diagrammet vil vi bevege oss direkte fra A til C. Pasienten har lite symptomer før det meste av HCO3- er brukt opp, men merker at han blir økende kortpustet (på grunn av den respiratoriske kompensasjonen). Ubehandlet vil pH kunne falle til kritiske verdier, og pasienten kan da bli blind eller dø. Dere vil forstå at en viktig behandling vil være å tilføre natriumbikarbonat (NaHCO3) for å motvirke den metabolske acidosen. Omtale av annen behandling finnes i Klinikkapitlet.
 Vis blodgassverdier
Vis blodgassverdier
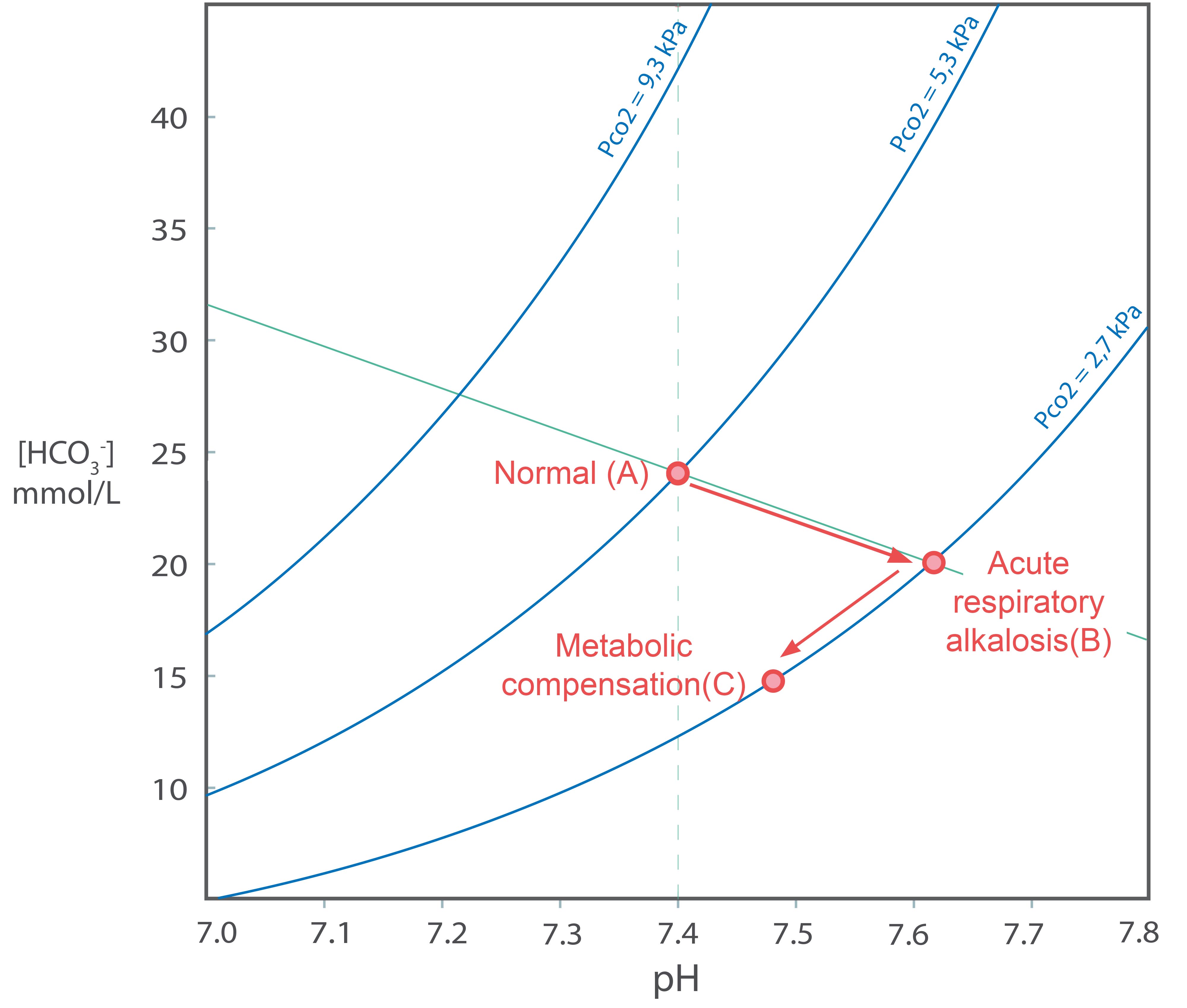
Alkaloser – tilstander med for høy pH – er klinisk sjeldnere enn acidoser. Ingen metabolske prosesser i kroppen produserer base som sluttprodukt. En metabolsk alkalose kan oppstå som resultat av gjentatte brekninger der pasienten mister magesyre (HCl). Magesyren skilles normalt ut i magesekken og nøytraliseres i duodenum. Når syren i stedet kastes opp, er det ekvivalent med at H+ fjernes fra høyre side av reaksjonslikningen (1). [H+] går ned, d.v.s. pH øker. På tilsvarende måte som for en metabolsk acidose vil organismen kompensere respiratorisk, men denne gangen ved å hypoventilere slik at pCO2 stiger og reaksjonslikningen drives mot høyre (H+ øker og pH faller). Vi får en respiratorisk kompensert metabolsk alkalose og ender opp i punktet C i Davenport-diagrammet. Denne kompensasjonen kan heller ikke bringe pH helt tilbake til 7,4.
 Vis blodgassverdier
Vis blodgassverdier
Pattedyr og fugl som normalt gjennomfører lange dykk (hval, sel, ender, pingviner), får under dykket en kombinert metabolsk og respiratorisk acidose. Den metabolske acidosen skyldes at muskelarbeidet under dykket gjennomføres delvis anaerobt. Det medfører at melkesyre slipper ut i blodet. Siden dyrene ikke puster under dykket, vil CO2 øke i blodet. Dette gir en respiratorisk acidose i tillegg til den metabolske lactacidosen. Like etter et langvarig dykk kan pH i arterielt blod være svært lav (f.eks. 6,8) mens [HCO3-] kan være normal. Den respiratoriske acidosen fører til høyere bikarbonatverdier, mens den metabolske fører til lavere. Kombinasjonen gir bikarbonatverdier mellom det de to ville gitt hver for seg, og kan derfor bli nær normale. Når dyret begynner å puste, vil CO2 raskt blåses av, og dyret har da en ren metabolsk acidose som det tar lengre tid å få korrigert.
Har dette eksemplet noen relevans for human medisin? Ja! En fødsel kan på mange måter sammenliknes med et dykk. Ved en normal fødsel vil gassvekslingen i placenta bli dårlig som resultat av gjentatte og kraftige rier. (Muskelkontraksjonene i uterus stanser all blodforsyning til placenta.) Etter en normal fødsel vil pH i blodet i venene i navlesnoren (som normalt fører arterialisert blod) ofte være nær 7,2 og paCO2 = 6,5-7,5kPa, altså en kombinert metabolsk og respiratorisk acidose. Ved en langvarig fødsel, kan verdiene bli ekstreme. Blodgassverdier og pH i blod fra navlesnoren gir holdepunkter for hvor alvorlig tilstanden er for barnet.
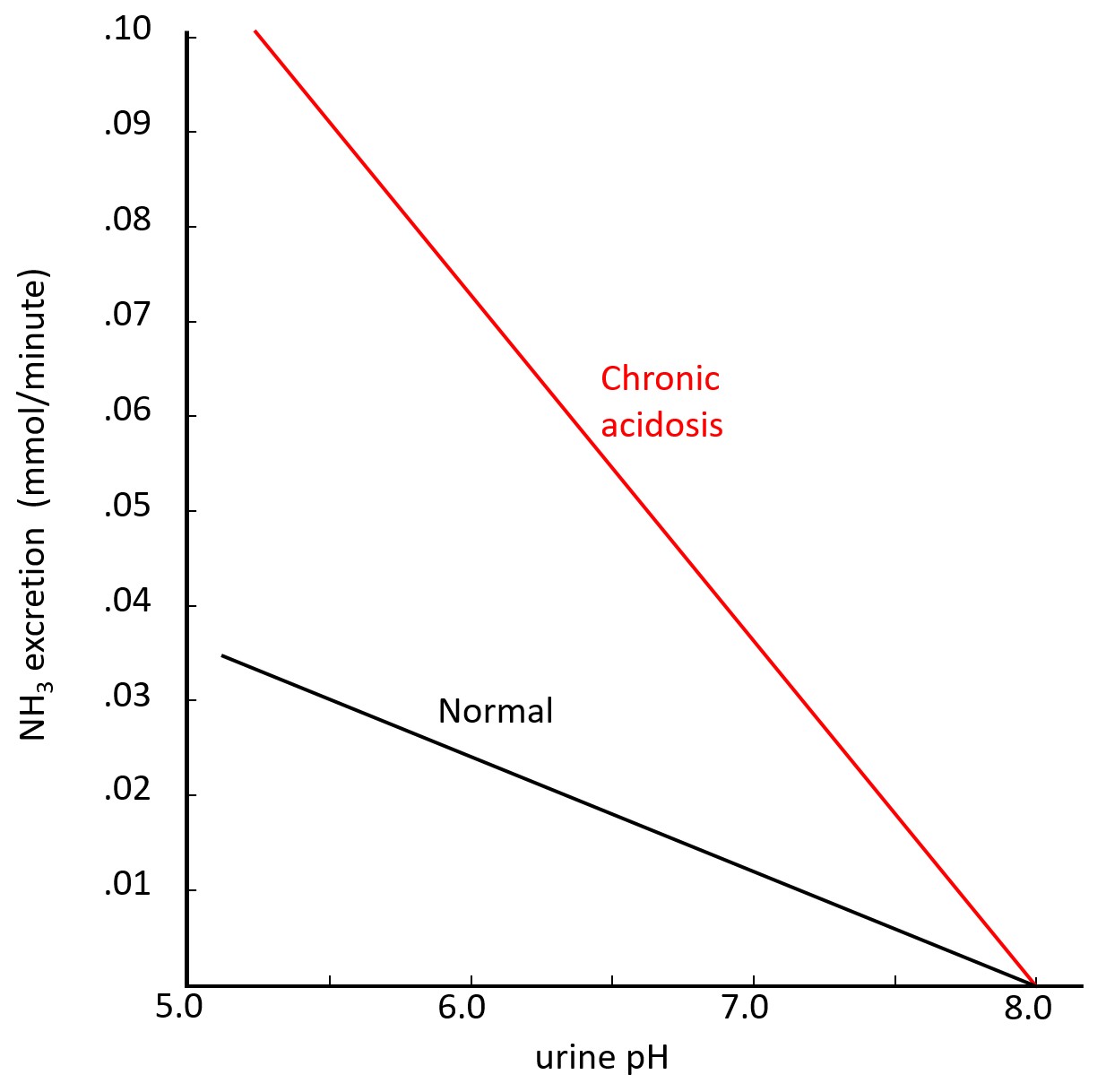
En respiratorisk acidose kompenseres ved at nyrene skiller ut syre. Denne utskillelsen er regulert av nyrene selv. Ingen hormoner eller annen informasjon fra andre av kroppens organer er involvert. Hvis pH i arterielt blod som kommer til nyrene, har pH lavere enn 8,0, skilles H+ ioner ut i primærurinen i distale tubulus. Utskilt mengde syre øker lineært med pH i blodet under 8,0 (Se figur). H+ ionene tas opp av ammoniakk (NH3) som omdannes til ammoniumioner (NH4+). Ammoniakkmolekylene dannes særlig i distale tubulus ved deaminering av aminosyren glutamin og noen andre aminosyrer. Ved en kronisk respiratorisk acidose induseres enzymet som er ansvarlig for deamineringen, slik at nyrene kan skille ut mer ammoniumioner og dermed mer syre. Mange næringsmidler som er vanlige i menneskers kost, gir sure nedbrytningsprodukter (svovelsyre fra svovelholdige aminosyrer, fosforsyre fra nukleinsyrer og fosfolipider osv.). Derfor er urinen som regel svakt sur. Under sterk syrebelastning kan pH i urinen gå ned til 4,5, men ikke lavere. Fosfationer er en viktig buffer i urin.
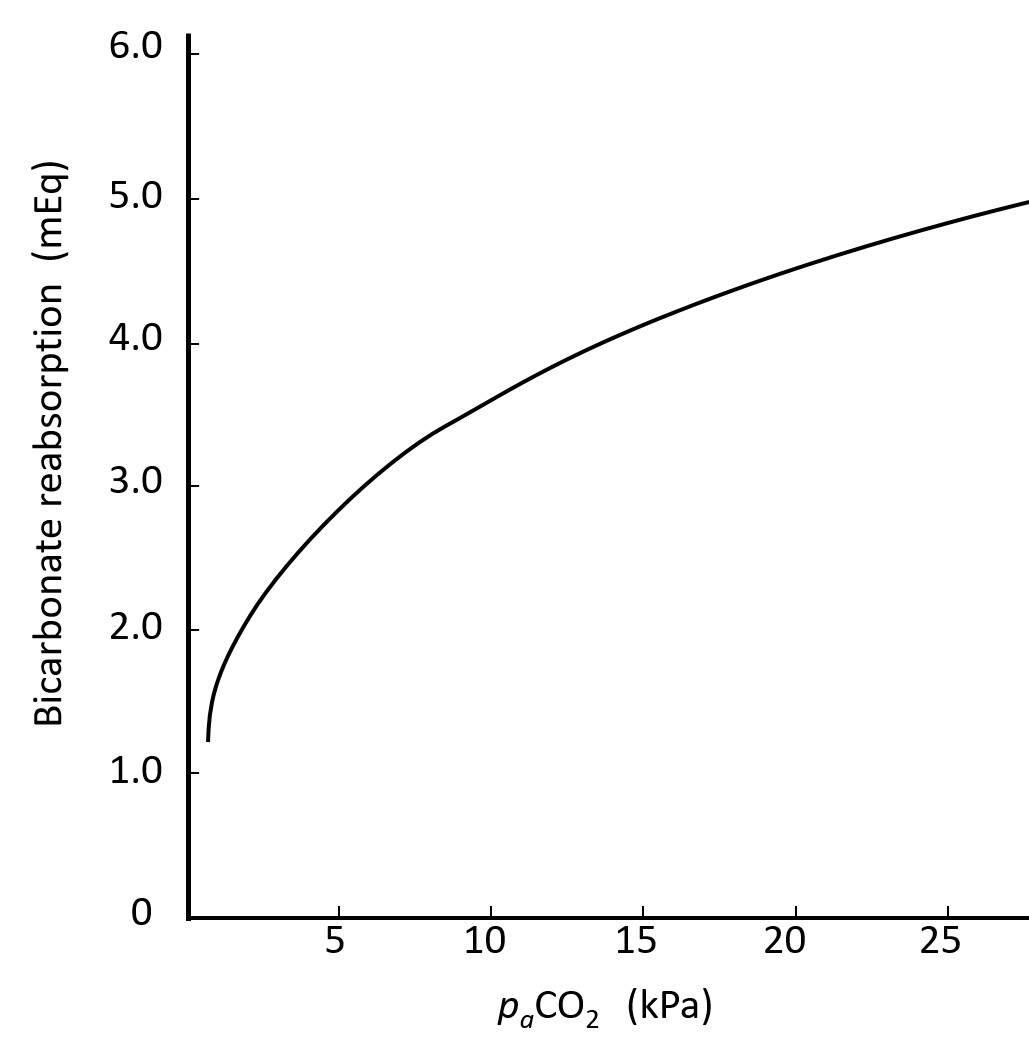
Når arterielt blod til nyrene er alkalisk, d.v.s. pH over ca 7,6, skiller nyrene ut base i form av bikarbonationer. Bikarbonationer filtreres i glomeruli og reabsorberes i tubulisystemet (se animasjon nedenfor). Denne reabsorpsjonen er en transportmaksimum-reabsorpsjon (Tm) på samme måte som reabsorpsjonen av glukose. Terskelen for reabsorpsjon - og dermed transportmaksimum - er imidlertid avhengig av paCO2 i arterielt blod til nyrene. Figuren nedenfor viser hvordan transportmaksimum øker med økende paCO2. Det makroskopiske resultatet er at bikarbonat reabsorberes fullstendig når pH i arterielt blod til nyrene er under 7,6, mens noe skilles ut i urinen når pH er over 7,6, uavhengig av paCO2. For en bestemt paCO2 er mengden bikarbonat som skilles ut, proporsjonal med differansen mellom arteriell pH og 7,4. Se også om syrer og baser i elæringsmodulen om nyrefysiologi.
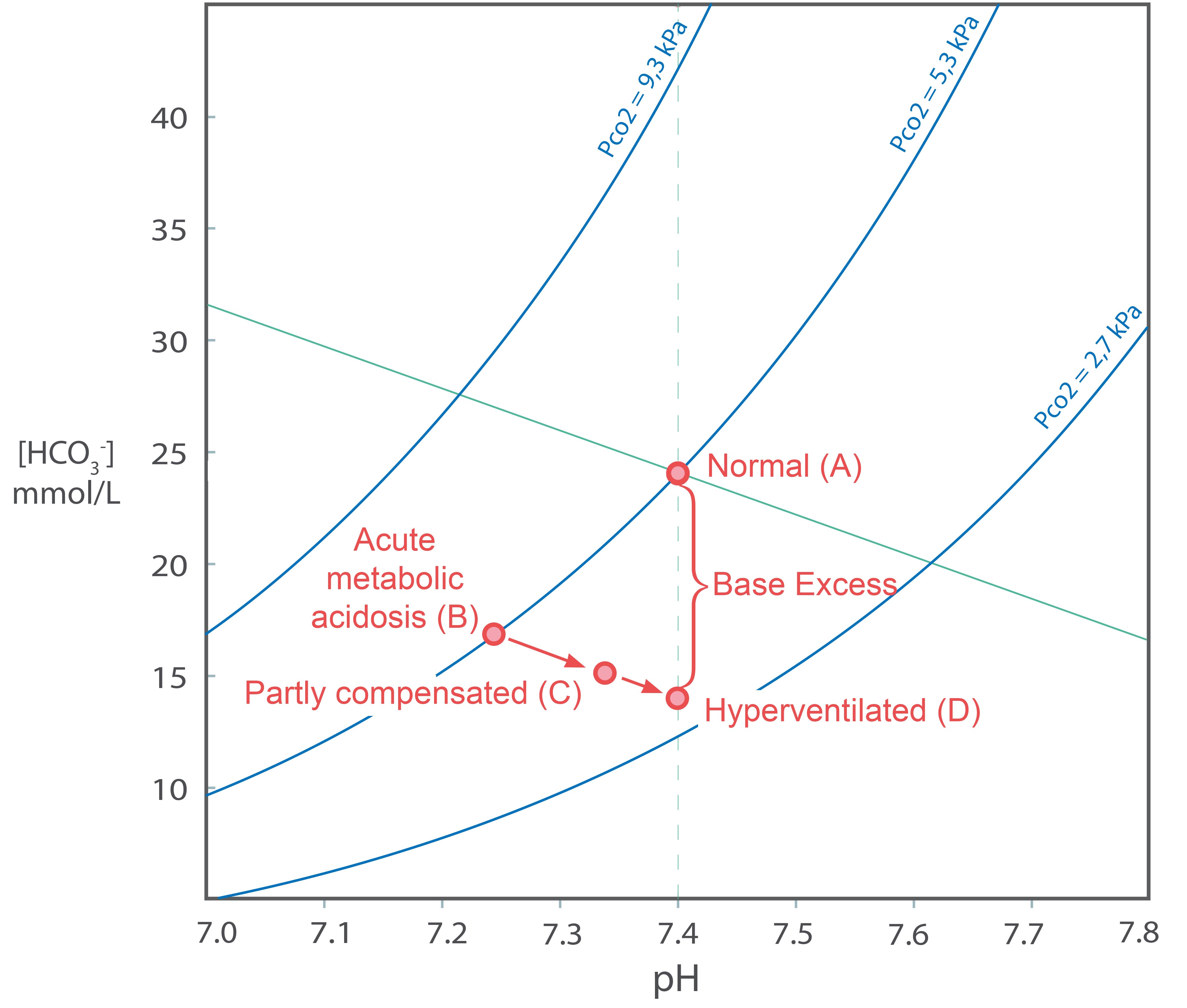
En avledet variabel som har vist seg å være svært nyttig ved klinisk vurdering av pasienter med syre-baseforstyrrelser, kalles gjerne "base excess" i Norge og forkortes BE, selv om vi godt kunne ha brukt norsk terminologi. Variabelen er beregnet ved at man estimerer hva bikarbonatkonsentrasjonen i arterielt blod ville ha vært om alle respiratoriske syre-base avvik var fullstendig korrigert med pusting, og deretter trekker fra normalverdien for denne variabelen (24 mmol/l). Dette kan best illustreres i et Davenportdiagram. Figuren viser en pasient som først har fått en akutt metabolsk acidose (punkt B). Bikarbonatkonsentrasjonen er da 17 mmol/l og pH er 7,25. Etter en tid er acidosen delvis kompensert (C). Bikarbonatkonsentrasjonen er nå 15 mmol/l og pH er 7,34. Husk at en respiratorisk kompensasjon av en metabolsk acidose ikke kan bli fullstendig. Hvis vi nå tenker oss at vi hyperventilerer pasienten slik at pH blir 7,4, vil bikarbonatkonsentrasjonen bli 13,5 mmol/l (D). Base excess er 13,5 mmol/l minus 24 mmol/l = -10,5 mmol/l. Vi skjønner at linjen fra B til D i figuren er nær parallell til normalbufferlinjen i Davenportdiagrammet.
Den definisjonen av BE som er gitt ovenfor, er vanskelig og komplisert å bruke i praksis. Den danske kliniske fysiologen Ole Siggaard-Anderen bestemte BE ut fra definisjonen i et stort antall pasienter med varierende pH og paCO2 verdier. Deretter tilnærmet han resultatene med en matematisk formel som derfor kan brukes til å bestemme BE ut fra pH og paCO2. De verdiene som regneformelen gir, blir i dag også oppgitt av blodgassapparater, men formelen har vært revidert flere ganger, og den er bare en tilnærmet modell av virkeligheten. De verdiene som formelen gir, er ikke nødvendigvis de korrekte i følge definisjonen for ekstreme syre-baseforstyrrelser. I praksis er imidlertid dette ikke en alvorlig begrensning.
Siggaard-Andersen framstilte BE i et diagram med pH langs x-aksen og logaritmen til paCO2 på y-aksen. For enhver BE verdi vil det så finnes en rett iso-BE linje. BE-linjene er ikke lik [HCO3- ]-linjene i Astrup diagrammet. Det er fordi Astrup diagrammet bare framstiller Henderson-Hasselbalchs ligning (2) og bikarbonat-bufferen, mens både fosfat- og proteinbuffere inngår i Siggaard-Andersens empirisk baserte diagram. Siggaard-Andersen diagrammet er det foretrukne i klinisk praksis.
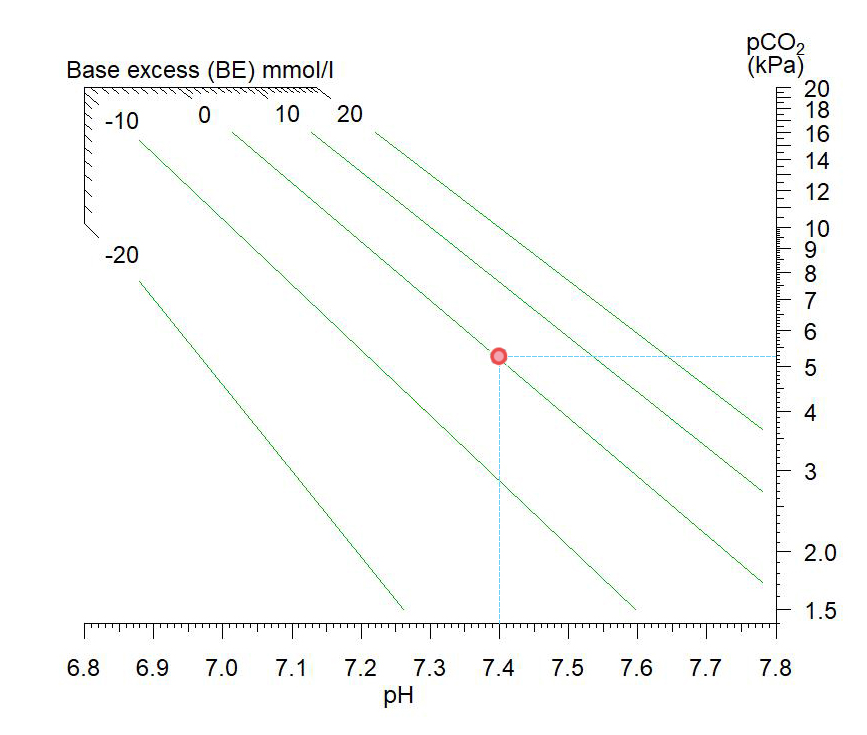
Hvis syre-baseforstyrrelsene bare hadde affisert blodet i blodårene, kunne vi ha brukt BE til å regne ut hvor mye NaHCO3 vi måtte ha tilsatt for nøytralisere den metabolske syren, og bringe både pH og bikarbonatkonsentrasjonen tilbake til normale verdier (f.eks. 5 l blod x 10,5 mmol/l = 52,5 mmol). Så enkelt er det imidlertid ikke. Syre-baseforstyrrelser har alltid spredd seg utenfor blodbanen, der vi også har buffersystemer som deltar. Hvor mye disse buffersystemene deltar, er avhengig av tidsforløpet til syre-baseforstyrrelsen. I interstitiell væske er det lite proteiner. Her er bikarbonatbuffersystemet det eneste av betydning. Det deltar raskt (0,5 – 2 timer) i en syre-baseforstyrrelse. Senere sprer syre-baseforstyrrelsen seg intracellulært. Her er mange proteinbuffere virksomme. Fosfatgrupper i skjelettet er også viktige som buffere. Hvis en acidose står lenge (mange timer), er intracellulære buffere ansvarlig for mer enn 50% av buffringen, mens buffere i blod bare er ansvarlig for omkring 15%. Resten skyldes buffere i interstitiell væske. BE gir oss derfor bare et bilde av hvor alvorlig den metabolske komponenten av syre-baseforstyrrelsen er, men kan ikke brukes til nøyaktige kvantitative beregninger.