For å vurdere syre-base-status er det nødvendig å ta en ABG (”arteriell blodgass”). Her måles blodets pH og partialtrykket av karbondioksid (paCO2), hvorpå bikarbonatkonsentrasjonen og baseoverskuddet (BE) beregnes. I moderne blodgassmaskiner gjøres dette av en computer der man nå rutinemessig også får målt Hb, paO2, SO2, HbCO, MetHb, elektrolytter, glukose og laktat.
En blodgassanalyse kan også tas i venøst blod. Under normale forhold vil da særlig pO2, og SaO2 være lavere, mens de øvrige parametrene er nesten like (pCO2 er kun ca. 0,6 kPa høyere enn i arterielt blod) (se tabell)). Innen intensivmedisinen brukes venøse blodgasser særlig for måling av sentralvenøs oksygenmetning (ScvO2) som er et godt surrogatmål for pasientens sirkulasjonsstatus, og egentlig et mål for balansen mellom tilbud og forbruk av oksygen i perifere vev. Prøven tas enkelt fra et inneliggende sentralt venekateter (referanseverdi: 72-78 %) – på samme måte som en ABG enkelt tas fra en arteriekanyle (”arteriekran”).
Selv om BE er en beregnet parameter med sine begrensinger (se ovenfor), gir den i klinisk praksis et meget godt uttrykk for den rene metabolske syre/base-forstyrrelsen. Forenklet kan vi si at fordi vi her har kalibrert blodet til en normal pCO2-verdi (5,3 kPa), foreligger ingen respiratorisk syre/base-forstyrrelse. Den mengde syre eller base (mmol) vi må tilsette per liter blod for å få pH tilbake til 7,40 er da et mål for den rene metabolske syre/base-forstyrrelsen.
| Syre-base blodgasser | Referanseområde |
|---|---|
| pH - surhetsgrad | 7,35-7,45 |
| paCO2 - arterielt partialtrykk for karbondioksyd | 4,7-6,0 kPa |
| HCO3- - hydrogenkarbonat | 22-26 mmol/L |
| BE - baseoverskudd (base excess) | -3 - +3 mekv/L |
| paO2 - arterielt partialtrykk for oksygen | 11-14 kPa |
| SaO2 - arteriell oksygenmetning av Hb | 95-100 % |
| Laktat | 0,5-1,5 mmol/L |
Anion gap brukes ofte i diagnostikk/utredning av pasienter med metabolsk acidose av ukjent årsak. Anion gap utgjøres vesentlig av de negative ladninger på plasmaproteinene, særlig albumin. Fordi albumin oftest faller (omtrent halveres) raskt hos intensivpasienter, må referanseområdet for anion gap samtidig justeres ned. Det samme gjelder for alkoholmisbrukere og andre underernærte pasienter med hypoalbuminemi. Den mest brukte korreksjonsformelen for dette er:
(0,25 er en konstant i omregningen fra albumin i g/L til antall negative ladninger/L)
Akutt respirasjonssvikt, for eksempel ved et fremmedlegeme i luftveiene eller kols forverring, medfører opphopning av CO2 og respiratorisk acidose. Ved alvorlig hypoventilasjon oppstår imidlertid snart også oksygenmangel i blodet og i vevene (hypoksi) med anaerob produksjon av melkesyre (som fører til laktacidose). Dette forklarer hvorfor uttalt respiratorisk acidose ofte ledsages av metabolsk acidose.
Behandlingen i dette tilfellet er å skaffe frie luftveier samt å gi oksygen og eventuelt kunstig/assistert ventilasjon (respirator).
Kronisk respirasjonssvikt med respiratorisk acidose oppstår hyppigst ved kroniske lungesykdommer eller ved sykdommer i muskel- og skjelettsystemet eller nervesystemet som nedsetter funksjonsevnen i respirasjonsmusklene. Ved disse tilstandene vil nyrene etter noen dager kompensere acidosen med å øke utskillingen av protoner i form av H2PO4– og ammonium (NH4+) i urinen, samt å reabsorbere mer bikarbonat. Dette kan få pH-verdien nesten tilbake til det normale selv om paCO2 fortsatt er forhøyet. Den renale kompensasjon vil føre til økt HCO3- og en økt (positiv) verdi av BE.
Behandlingen rettes mot grunnsykdommen. Hvis respiratorbehandling er nødvendig, må en starte varsomt og gradvis øke ventileringen til pasientens antatte habituelle (”vanlige”) verdier. Den renale kompensasjonen av acidosen kan nemlig fortsette i flere dager, og en brå senkning i paCO2 til normalområdet ved respiratorbehandling kan derfor gi en alvorlig metabolsk alkalose.
Metabolsk acidose
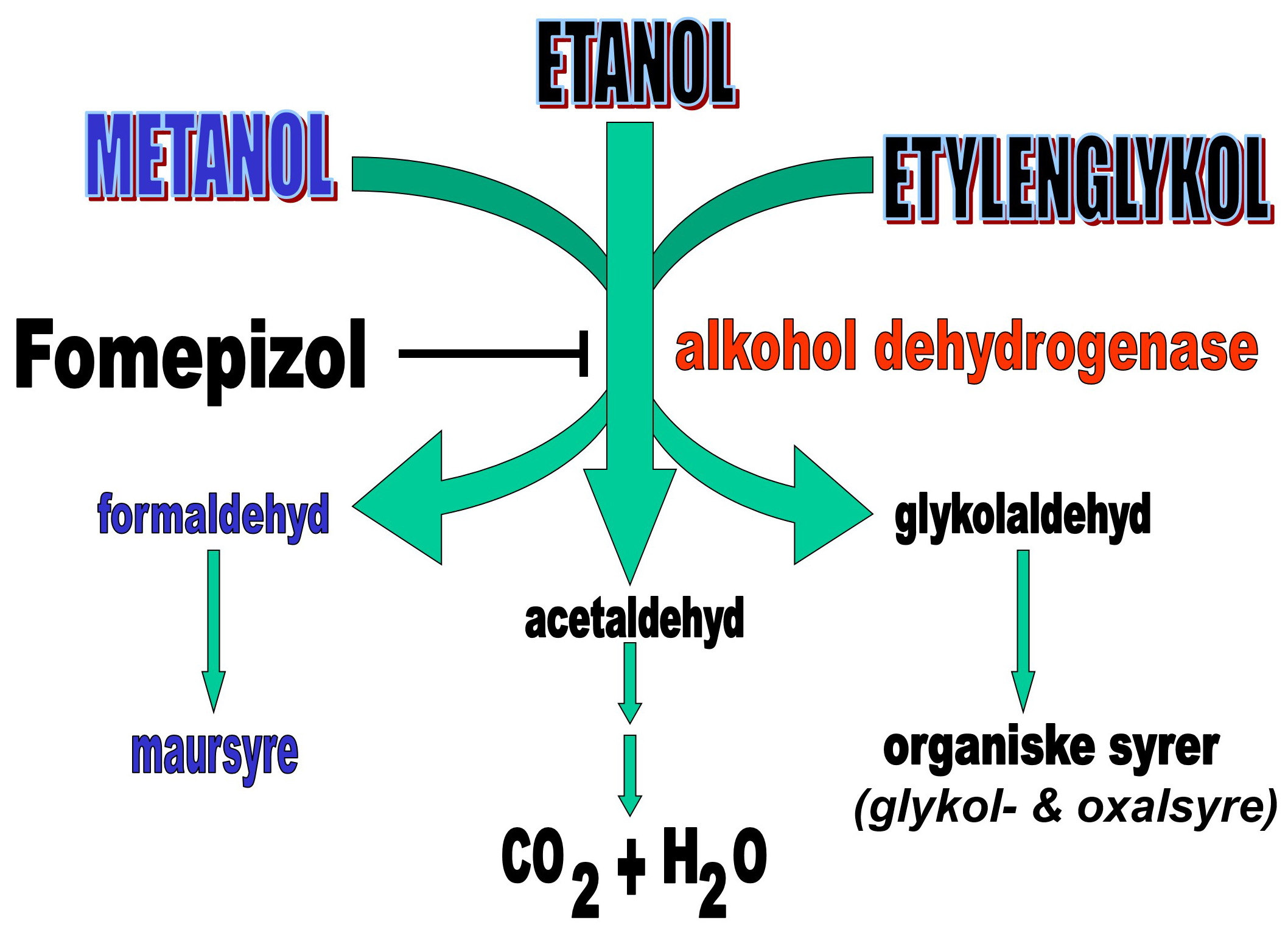
En metabolsk acidose kan ha forhøyet (hyppigst) eller normalt anion gap. Acidose med normalt anion gap skyldes tap av bikarbonat eller (tilført) overskudd av klorid, slik at kloridmengden i blodet øker omtrent tilsvarende fallet i bikarbonat (såkalt hyperkloremisk acidose). Vanlig isotont saltvann (NaCl 154 mmol/L) inneholder «ufysiologisk» høye konsentrasjoner av begge ioner, mest av klorid. Acidose med økt anion gap skyldes opphoping av anioner fra metabolske syrer, for eksempel ketosyrer ved diabetisk ketoacidose, melkesyre ved hypoperfusjon og vevshypoksi - eller maursyre ved metanolforgiftning (se animasjon under fysiologikapitlet).
Behandlingen av metabolsk acidose rettes mot årsaken/grunnsykdommen.
Ved uttalt acidose hos en hemodynamisk ustabil pasient, gis det i tillegg natriumhydrogenkarbonat (NaHCO3) eller en kombinasjon av flere baser (Tribonat) intravenøst, for straks å korrigere pH noe opp.
Ved uremi gis ofte natriumhydrogenkarbonat peroralt (Natron).
Ved diaré (tap av HCO3- og K+) gis Ringer-acetat tilsatt KCl og eventuelt natriumhydrogenkarbonat (natriumbikarbonat) intravenøst.
Ved metanolforgiftning gis i tillegg motgifter (fomepizol eller etanol) som blokkerer metabolismen av metanol til formaldehyd – og senere til maursyre (se figur nedenfor). Behandling med dialyse vil effektivt kunne fjerne både metanol og maursyren – og brukes i alvorlige tilfeller.
Forgiftning med etylenglykol (brukes i frostvæske) har mekanistiske og terapeutiske likehetstrekk med metanolforgiftning (se figur).

Det er vanskelig å angi kritiske/dødelige pH-verdier, men erfaringsmessig vil en pH over tid lavere enn 6,8 eller høyere enn 7,8, være uforenlig med liv. Forskning på metanolforgiftninger som karakteriseres av metabolsk acidose pga. metanolens metabolisme til maursyre, har imidlertid vist at det ikke bare pH i seg selv som er viktig, men også (og kanskje viktigere) i hvilken grad man er i stand til respiratorisk å kompensere den økende metabolske acidosen. Et velfungerende buffersystem i form av god respirasjonsfunksjon (uten kols, aspirasjonspneumoni eller CNS-depresjon) blir således også viktig for overlevelse ved metabolsk acidose.
Årsaker til metabolsk acidose, både med normalt og økt anion gap.
| Årsaker | Tilstander | |
|---|---|---|
| Metabolsk acidose med økt anion gap, men normal klorid |
Økt produksjon av ikke-flyktige organiske syrer Nedsatt utskilling av ikke-flyktige uorganiske syrer |
Diabetisk ketoacidose (med ketosyrer = ketonlegemer) Laktacidose på grunn av vevshypoksi (melkesyre) Metformin (melkesyre) Metanol (maursyre) Etylenglykol (glykolsyre) Acetylsalisylsyre (salicylsyre, melkesyre) Nyresvikt med uremi (svovelsyre, fosforsyre, diverse avfallssyrer) |
| Metabolsk acidose med normalt anion gap og økt klorid |
Tap av bikarbonat (HCO3-)
Overbehandling med natriumklorid (NaCl) intravenøst Forgiftning med NaCl |
Diaré Tarmfistel- og stomi-tap Renal tubulær acidose |
Respiratorisk alkalose har ofte psykiske årsaker ("hyperventilasjonssyndrom"), men kan også skyldes sepsis, sterke smerter, overbehandling med respirator, organisk hjernesykdom eller høy feber. Ved forgiftning med acetylsalisylsyre oppstår det respiratorisk alkalose i de tidlige stadier, fordi dette legemidlet stimulerer respirasjonssenteret i hjernen. Den renale kompensasjonen ved respiratorisk alkalose består i å øke utskillingen av bikarbonat. Det skjer ved at det filtrerte bikarbonatet ikke reabsorberes i nyrene. I klinisk praksis er det imidlertid sjelden at en respiratorisk alkalose varer lenge nok til at renal kompensasjon inntrer. Unntaket er stort sett kun organiske hjerneskader.
Ved psykisk betinget hyperventilasjon kan paCO2 reduseres til 2,5 kPa, sjelden lavere. Dette medfører alkalose og en derfor større binding av kalsium til albumin slik at det oppstår redusert plasmakonsentrasjon av ionisert Ca++, som er den aktive delen. Slik relativ hypokalsemi kan medføre skjelvinger, rykninger og kramper i muskulaturen. Dette gjør pasienten enda mer engstelig, slik at hyperventileringen fortsetter, og han kommer inn i en ond sirkel.
Behandlingen går ut på beroligende nærvær/samtale og at man utelukker alvorlige årsaker (sepsis). Unntaksvis lar man pasienten puste gjennom et rør eller i en pose slik at innholdet av karbondioksid i respirasjonsluften øker; eventuelt gis beroligende midler, for eksempel diazepam (Vival, Stesolid).
Metabolsk alkalose
Ingen sykdom produserer base i kroppen. Metabolsk alkalose skyldes derfor enten tilførsel av base (sjelden) eller tap av syre (H+-ioner) eller klorid. Sistnevnte medfører kompensatorisk økt konsentrasjon av bikarbonat slik at elektronøytraliteten opprettholdes. Økningen i bikarbonat medfører at bufferlikningen (1) skyves mot venstre, slik at H+ avtar og pH øker.
Årsaker til metabolsk alkalose.
| Årsaker | Tilstander |
|---|---|
| Tap av klorid |
Brekninger (tap av HCl; H+ Cl-). Langvarig bruk av diuretika (furosemid, tiazider) medfører økt utskilling av klorid og natrium. |
| Andre årsaker |
Overbehandling med bikarbonat, intravenøst eller peroralt (Natron). Respiratorbehandling av kronisk respiratorisk acidose som er renalt kompensert (utskillingen av syre (H+) og klorid i urinen vedvarer). Hypovolemi. Tap av vann konsentrerer HCO3- (”contraction alkalosis”) |
Metabolsk alkalose ledsages gjerne av hypokloremi og hypokalemi. Ved en uttalt hypokalemi kan imidlertid reabsorbsjonen av natrium i distale nyretubuli foregå samtidig som H+ blir skilt ut i stedet for kalium (kroppen prioriterer altså kaliumhusholdningen fremfor syre-base-balansen). Urinen blir da sur (såkalt paradoksal aciduri) - til tross for at pasienten er alkalotisk og burde spare på syre. Dette bidrar til å opprettholde alkalosen. Ved behandling av alkalose er det derfor spesielt viktig å tilføre kalium for å rette opp kaliumbalansen og motvirke paradoksal aciduri - som forverrer alkalosen. Behandlingen rettes mot årsaken. Mot alkalosen gis vanligvis isotont natriumklorid (154 mmol/l) intravenøst. Denne væsken inneholder et betydelig overskudd av klorid i forhold til den normale konsentrasjonen i ECV, og retter opp underskuddet av klorid i pasientens ECV. Ringer acetat bør ikke brukes mot hypovolemi (og alkalose) fordi acetat omdannes til bikarbonat i leveren. Kaliumtilførsel er viktig og tilsettes oftest i isotont saltvann (40 mmol KCl per liter). En klassisk feil er bruk av peroral kaliumcirat (Kajos mixtur) i slike tilfelle. Dette vil bidra til at alkalosen opprettholdes fordi citrat metaboliseres til bikarbonat i leveren.
Metabolsk alkalose på grunn av (over-)korreksjon av metabolsk acidose med natriumbikarbonat er forbigående, og nå sjelden, fordi basekorreksjon vanligvis kun benyttes ved uttalt metabolsk acidose. Argininklorid er et surt salt som avgir saltsyre (HCl) når det metaboliseres i leveren, men er sjelden nødvendig for å korrigere metabolsk alkalose.
Kompensasjonsmekanismer
Den renale kompensasjonen ved acidose via ammoniakk- og fosfatbuffersystemene inntrer først etter flere timer - og blir maksimal først etter dager. Ammoniakk (NH3) avspaltes fra aminosyren glutamin i nyretubulicellene, og til hvert ammoniakkmolekyl og fosfatanion som skilles ut i urinen, bindes et hydrogenion. I tillegg vil det utskilles mer klorid og bikarbonatbuffersystemet vil sørge for at alt filtrert bikarbonat reabsorberes. Denne kombinasjonen av økt renalt tap av H+-ioner og økt reabsorpsjon av bikarbonat medfører en positiv verdi av BE i syre-basestatus, dvs. en sekundær, renalt betinget metabolsk alkalosekomponent.
De renale buffersystemene er effektive både ved respiratorisk og ved metabolsk acidose. Ved metabolsk acidose er den respiratoriske kompensasjonen den viktigste de første dagene, før den renale korrigeringen er fullt utviklet. Ved nyresvikt har nyrene nedsatt evne til å kompensere en acidose. Ved alkalose består den renale kompensasjonen i økt utskilling av bikarbonat.
Tolking av syre-base-forstyrrelser ("blodgasser")
Syre-base-forstyrrelser er både kompliserte og vanskelige å forstå. Det er derfor viktig at man tolker de etter et bestemt mønster – og at man ikke "hopper på en konklusjon". En blodgass må heller ikke tolkes uten at man sammenholder den med pasienten man har undersøkt - og skal behandle. Følgende fremgangsmåte har vist seg hensiktsmessig i klinisk praksis:
Noen ganger glemmer man at to syre-base-forstyrrelser kan opptre samtidig – uten at den ene er en kompensasjon (og motsatt rettet forstyrrelse) av den andre. Vi snakker derfor også om en 5. type forstyrrelse – nemlig den kombinerte typen. Eksempler på dette er kombinert/samtidig metabolsk alkalose og acidose eller samtidig respiratorisk alkalose og metabolsk acidose ved sepsis og salicylatforgiftning. Forståelsen av dette er viktig også for å stille diagnosen tidlig ved disse alvorlige tilstandene – som effektivt kan behandles om man bare påviser de tidlig. Ved forsinket diagnostikk kan utfallet ofte bli fatalt.
Et eksempel på en kombinert metabolsk alkalose/acidose kan være en pasient med stadige «sure» brekninger hvor man taper H+ og gradvis blir dehydrert og hypotensiv. Tapet av hydrogenioner (syre) medfører en metabolsk alkalose mens hypotensjonen kan gi hypoperfusjon av muskulatur med laktacidose på grunn av anaerob glykolyse. I enkelte tilfeller kan disse to motsatt rettede syre-baseforstyrrelsene utlikne hverandre – og BE blir da innen referanseområdet. I slike tilfelle er det viktig å kjenne til sykehistorien – og ha undersøkt pasienten som åpenbart må ha metabolske syre-baseforstyrrelser. Fordi BE er en resultantparameter kan den imidlertid bli normal (eller nesten normal) i slike tilfeller (se senere kliniske eksempler).
Ved salicylatforgiftning inntrer først en respiratorisk alkalose (med hypokalemi) pga syrens stimulering av respirasjonssenteret. Senere i forløpet inntrer økende metabolsk acidose (alvorlige tilfelle) med laktacidose (type B) grunnet ”frikopling” av respirasjonskjeden i mitokondriene.
Ved sepsis inntrer vanligvis først en hyperventilering med respiratorisk alkalose (antatt cytokinstimulering av respirasjonssenteret) før det gradvis utvikles kompromittert mikrosirkulasjon og påfølgende laktacidose på grunn av DIK (forbrukskoagulopati, disseminert intravaskulær koagulasjon) og fallende blodtrykk. I tillegg inntrer en dysregulert mitokondriefunksjon og overbelastet glykolyse som begge fremmer produksjonen av laktat. Noen feiltolker disse blodgassverdiene (lav paCO2 og negativ base excess) og bruker tid på å utrede hva som her er den primære syre/baseforstyrrelsen og hva som er den kompensatoriske forstyrrelse – noe som forsinker diagnostikken ved disse alvorlige tilstandene.
Elektrolytter
Fordi bikarbonat er en viktig buffer i syre-base-balansen og samtidig et viktig anion, er det en nær forbindelse mellom forstyrrelser i syre-base-balansen og elektrolyttbalansen. Den vanligste elektrolyttforstyrrelsen er imidlertid hypo-/hyperkalemi som først og fremst relateres til skifte (redistribusjon) av kalium over cellembraner. I tillegg gis en kort omtale av forstyrrelser av s-kalsium og s-natrium ved syre-base-forstyrrelser.
Ved metabolsk acidose som skyldes tap av bikarbonat (for eksempel ved tarmfistler og diaré), øker kloridkonsentrasjonen, fordi mengden anioner vil være konstant og lik mengden kationer. Slik hyperkloremisk acidose kan også oppstå ved store infusjoner av fysiologisk saltvann eller kolloider, som også vanligvis inneholder NaCl 154 mmol/l som basisløsning (de inneholder ”ufysiologisk” mye klorid, den normale plasmakloridkonsentrasjonen er ca. 100 mmol/l).
Ved acidose foreligger vanligvis hyperkalemi, men årsakene er komplekse. Hvis celler utsettes for oksygenmangel eller acidose, hemmes den energikrevende natrium-kalium-pumpen, slik at kalium strømmer ut av cellene og gir hyperkalemi. Dette blir registrert av nyrene, som svarer med å skille ut mer kalium. Dette nettotapet av kalium tross (ekstracellulær) hyperkalemi er imidlertid av liten betydning med mindre man har osmotisk (økt) diurese ved utvikling av diabetisk ketoacidose og hyperglykemi. Ved acidose vil også overskuddet av H+ (som genereres intracellulært, eksempelvis ved generell hypoksemi og etterfølgende laktacidose) fortrenge K+ som kation bundet til intracellulære strukturer. K+ lekker ut av cellene og øker s-kalium. En mye brukt forenklet forklaring om at H+ buffres intracellulært i bytte med K+ som lekker ut, er således ikke helt korrekt som eneste forklaring, men synes som en god modell for H+ som produseres i lever (diabetisk ketoacidose, metanolforgiftning) og derfra transporteres rundt i kroppen.
Ved alkalose går K+ intracellulært i bytte med H+ som går ut for å motvirke alkalosen. Ved acidose/alkalose endres således serum-kalium med 0,3–0,5 mmol/l per 0,1 endring av blodets pH (pH 7,4 til 7,0 øker S-kalium med 1,2-2,0 mmol/l). Forholdet er ikke helt lineært fordi pH-skalaen er logaritmisk. Serum-kalium stiger ved acidose og synker ved alkalose.
Ved metabolsk alkalose er klorid lav, som regel på grunn av tap av saltsyre HCl ved sure brekninger eller i ventrikkelsondeaspirat, eller ved tap av klorid i urinen ved diuretikabehandling. Bikarbonat blir sekundært forhøyet – og pasienten får metabolsk alkalose. Kalium vandrer intracellulært ved alkalose (i bytte med H+) slik at pH og det ekstracellulære kaliuminnholdet (s-kalium) reduseres. I tillegg til redistribusjonen over cellemebranen foreligger også et reelt tap av kalium via brekningene eller diuresen. Metabolsk alkalose er derfor ledsaget av hypokloremi og hypokalemi (en eldre deskriptiv betegnelse var derfor ”hypokloremisk, hypokalemisk alkalose”).
Nær halvparten av kalsium i blodet (s-kalsium) er inaktivt og bundet til albumin. Den andre halvdelen er ionisert og fysiologisk aktivt (fritt, ionisert kalsium). Denne proteinbindingen er pH-avhengig. Ved alkalose øker den (gir redusert fritt kalsium) og omvendt reduseres den (gir økt fritt kalsium) ved acidose. Denne pH-avhengige proteinbindingen er viktig å forstå ved hyperventilasjonssyndrom: Den akutte respiratoriske alkalosen medfører lavt, ionisert kalsium som kan medføre tetani (fingrene presses sammen i en smertefull "fødselshjelperstilling"). Dette oppfatter pasienten ofte som "kramper" – noe som forsterker angsten/hyperventilasjonen og dermed alkalosen – og en selvforsterkende ondartet sirkel dannes. Behandlingen består i beroligende samtale kombinert med ditto medikamenter. I ekstreme tilfelle kan pasienten puste gjennom et rør/plastpose med hull (gir økt paCO2).
To ting bør man vite om Na+ og acidose: Ved diabetisk ketoacidose og (meget) høyt blodsukker (s-glukose), vil glukosens osmotiske effekt trekke vann ut av cellene og derved fortynne ekstracellulært s-natrium, som dermed måles for lavt. Ved s-glukose over 20-30 mmol/l bør man derfor beregne glukosekorrigert s-natrium etter formelen:
Ved korreksjon av metabolsk acidose med natriumbikarbonat (167 mmol/l (isoton væske) eller 500 mmol/l (hyperton væske)) vil pasienten kunne påføres en hypernatremi. Denne blir imidlertid sjelden alvorlig og kan motvirkes ved infusjon av glukose (= vann) eller tilførsel av vann via magesonde.