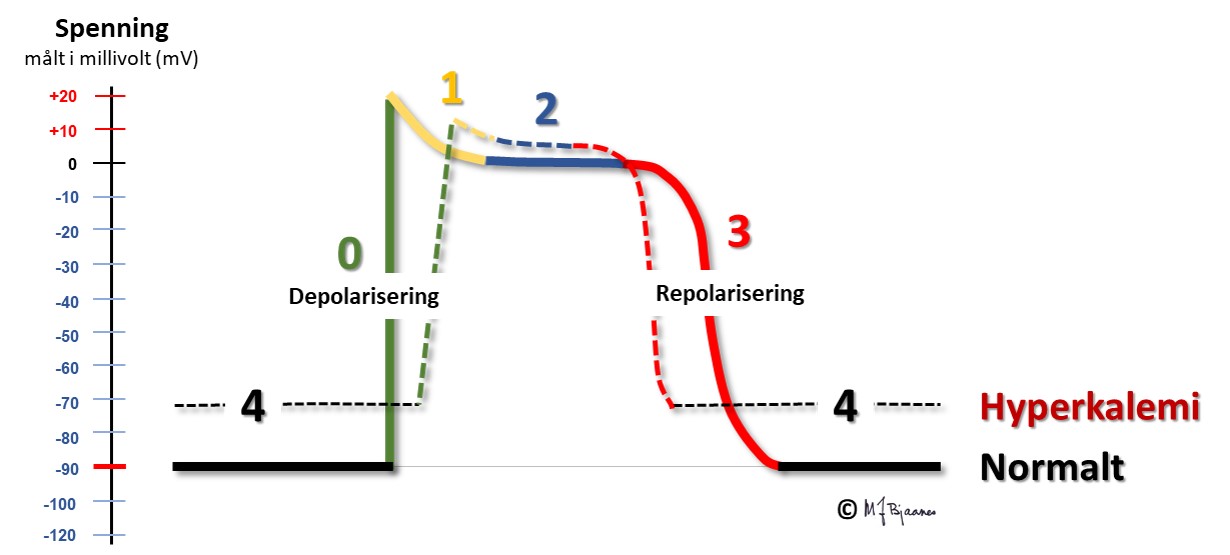
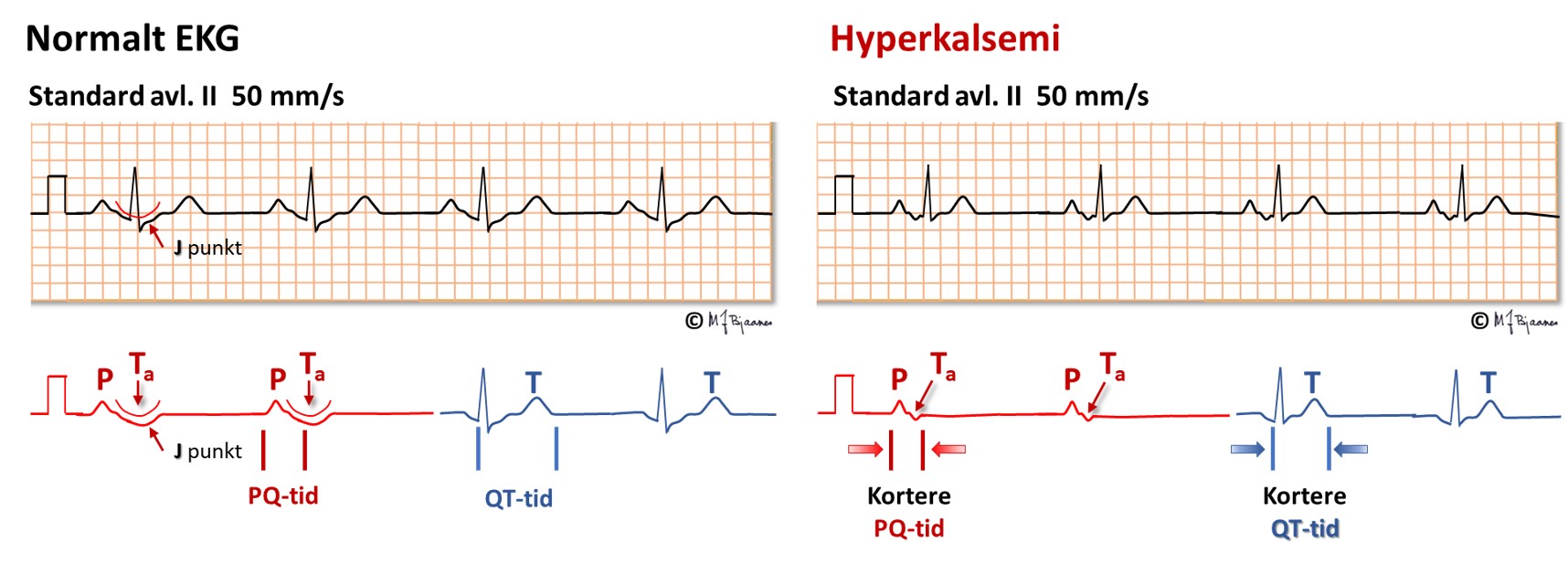
Forskjellen i kaliumkonsentrasjon mellom inn- og utsiden av cellen er den viktigste faktoren som bestemmer hvilemembranpotensialet. Derfor vil selv små forandringer i ekstracellulær K+-konsentrasjon få stor betydning. Ved hyperkalemi blir forskjellen i kalium på innsiden og utsiden av cellemembranen mindre enn vanlig, så hvilemembranpotensialet blir mindre negativt. I en slik situasjon blir depolariseringshastigheten lavere (dV/dt synker) og impulsutbredelsen langsommere, eller endatil stopper helt (blokk). Ved hypokalemi blir forskjellen mellom innsiden og utsiden av cellemembranen større enn normalt, og hvilemembranpotesialet mer negativt. Motsatt hva man umiddelbart skulle tro, blir kaliumstrømmen ut av cellen hemmet av manglende kalium på utsiden av cellen. Dette skjer fordi kaliumkanalenes funksjon avhenger av kaliumkonsentrasjonen på utsiden og medfører bl.a. at repolariseringen av cellene blir svekket, og aksjonspotensialet blir lengre.
Ved iskemi/infarkt svikter de energikrevende ionepumpene, og det blir lokal opphopning av K+-ute og lokalt lavere spenningsforskjell over cellemembranen (mindre negativt hvilemembranpotensial). Dette disponerer for lokale blokk og (som Del 4 utdyper) sirkelstrøm-takykardier. I tillegg vil forskjellen mellom membranpotensialene i friske og iskemiske celler gi en skadestrøm som også disponerer for arytmier.
Hyperkalemi ses først og fremst ved nyresvikt (uremi), diabetisk ketoacidose og hos pasienter som bruker hemmere av aldosteron-angiotensinsystemet. Figuren viser at aksjonspotensialet da starter fra et mindre negativt membranpotensial og blir langsommere depolarisert, får kortere platåfase (fase 2) og raskere repolarisering.

Et mindre negativt hvilemembranpotensial gir langsommere impulsutbredelse og fører til at
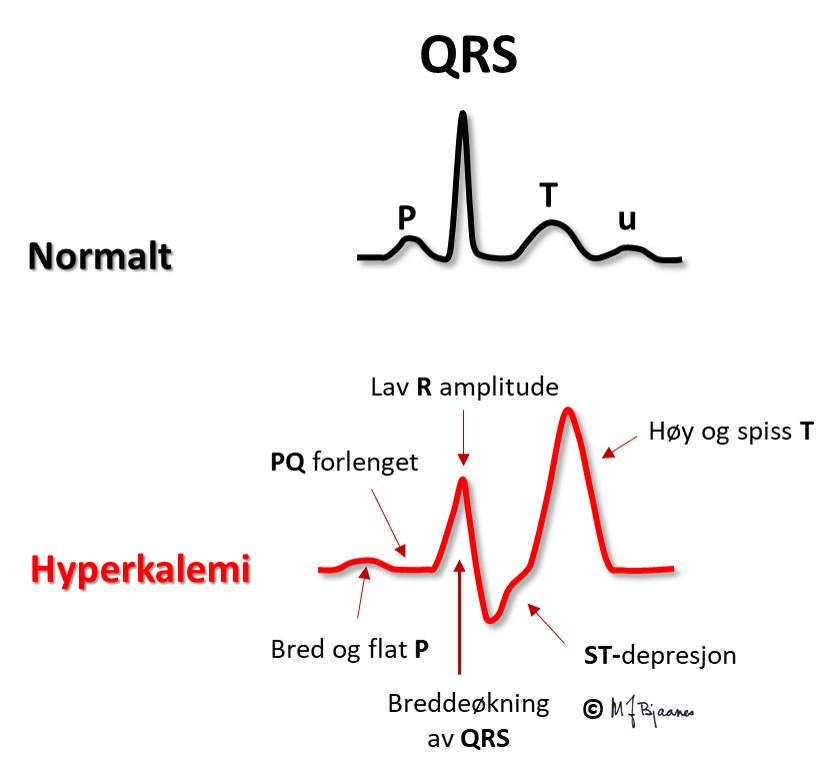
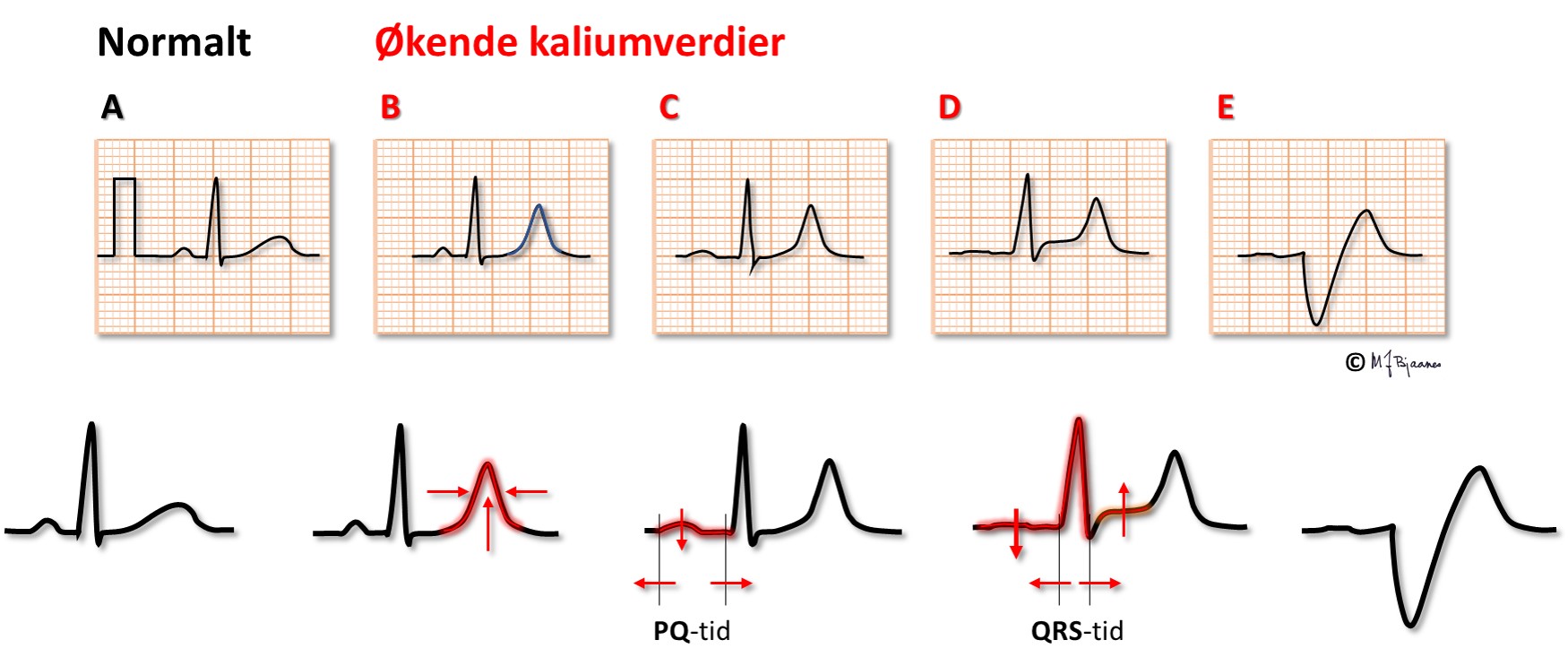
Hvis s-K+ blir høy nok, kan P-bølgene forsvinne og hjertet stanse. Under åpen hjertekirurgi stanses ofte hjertet med infusjon av en kardioplegivæske med høy kaliumkonsentrasjon.
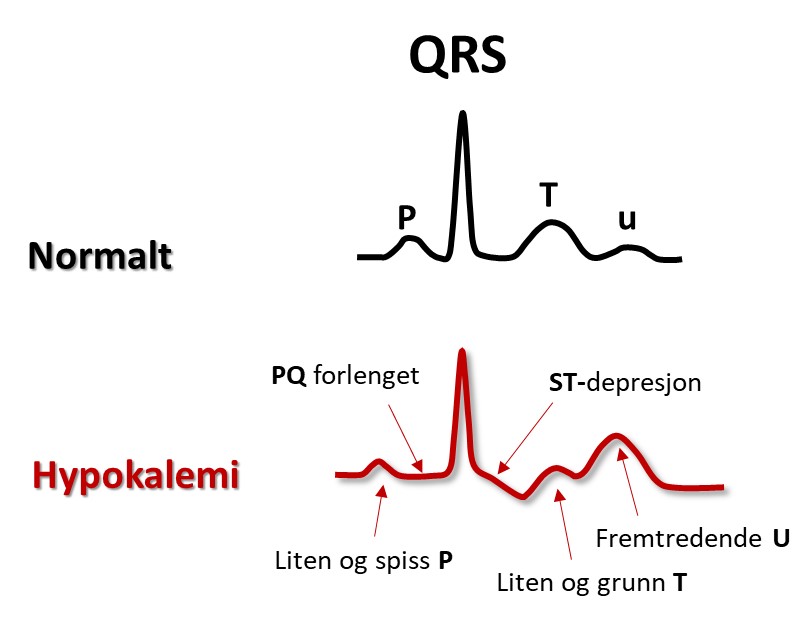
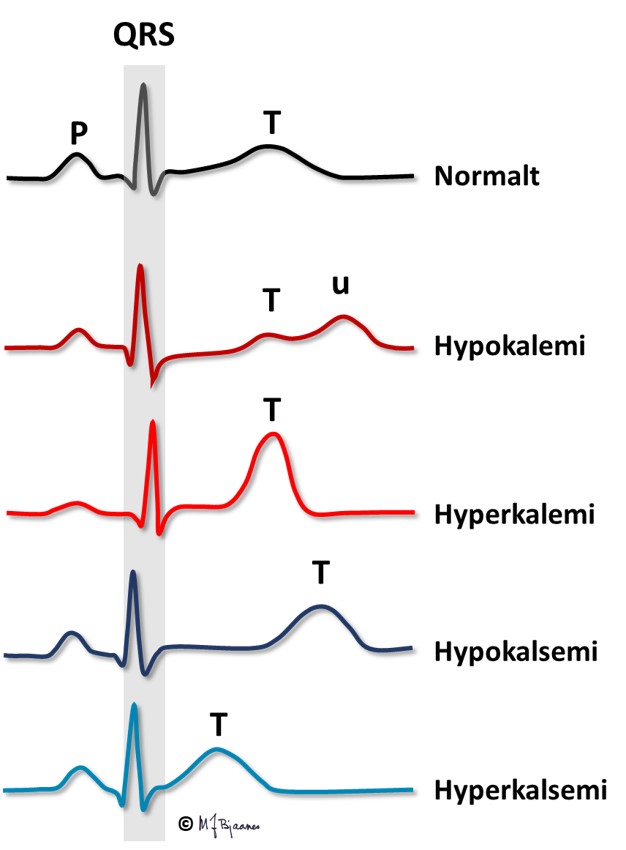
Hypokalemi ses hos pasienter som bruker vanndrivende medisin og ikke spiser en balansert diett, ved diaré, binyreproblemer og ved behandling av diabeteskoma. Ofte er det samtidig magnesiummangel. Den lave K+-konsentrasjonen ekstracellulært gir hyperpolariserte myocytter (ekstra negativt membranspotensial). Impulsutbredningen går da raskt, men repolariseringen går langsommere fordi kaliumkanalene paradoksalt nok leder strøm dårligere. Aksjonspotensialet blir derfor lengere, og dette gjenspeiles i QT-tiden, som forlenges. Dette medfører økt arytmifare, både fordi hyperpolariserte myocytter lettere aktiveres av impulser fra naboceller, og fordi spontan aktivering av myocyttene lettere oppstår ved trigget aktivitet eller automati (mer i Del 4). Ved vanskelig kontrollerbare arytmier kan infusjon av kalium og magnesium noen ganger dempe arytmitendensen og roe situasjonen.
Mens s-kalium regulerer både T-amplituden og aksjonspotensialets varighet (og dermed QT-tiden), påvirker s-Ca2+ vesentlig bare QT-tiden.
Hyperkalsemi ses ved overaktive paratyreoideakjertler og i blant ved kreft som har angrepet skjelettet. Ved hyperkalsemi forkortes QT; hos en pasient som har sterkt svingende kalsiumnivå i blodet, kan QT-tiden i EKG gi et grovt estimat på s-Ca2+ -verdien.
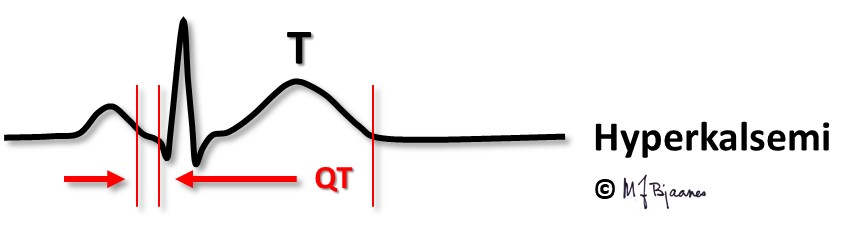
Også aksjonspotensialet i atriet forkortes, slik at atriets T-bølge, Ta, kan fristilles og til og med komme i forkant av QRS.
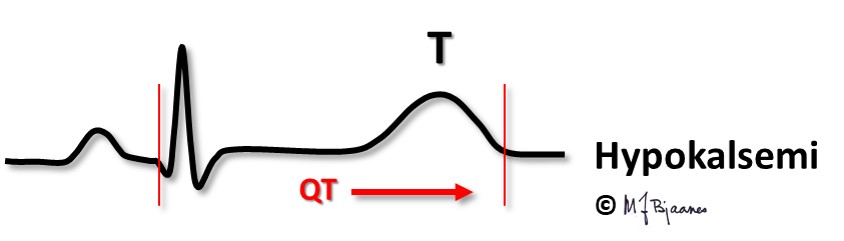
Hypokalsemi ses ved paratyreoideasvikt og ved D-vitaminmangel. QT-tiden blir da forlenget, og dette disponerer for arytmier (omtales i Del 4).
Forstyrrelser i ekstracellulære kalium- og kalsiumkonsentrasjoner påvirker EKG. En kunne tenke seg at også natriumkonsentrasjonen kunne påvirke EKG, men så store avvik som det ville kreve, er dødelige av andre årsaker.
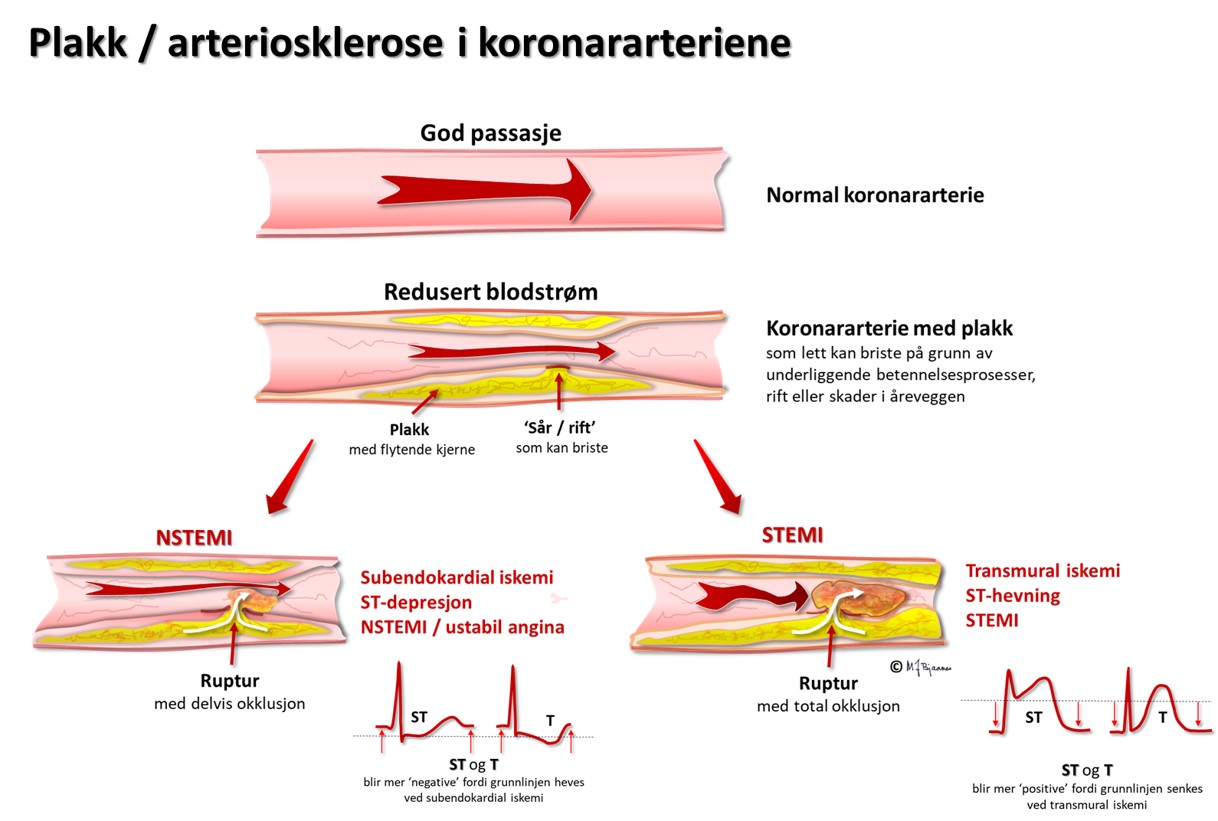
Iskemi medfører energimangel, og energikrevende ionepumper svikter. Spesielt viktig er den ATP-drevne Na+/K+-pumpen. Dessuten medfører iskemi at cellembranen lekker natrium inn i cellene (se del 2). Etter hvert får de iskemiske cellene et mindre negativt hvilemembranpotensial enn det de friske nabocellene har, og derfor blir det en diastolisk skadestrøm fra de syke til de friske områdene (strømmen går i retning av det mest negative området). Hvis hele myokard (endo- til epikard) i området er rammet, går denne «skadestrømmen» vekk fra de EKG-elektrodene som ligger rett over det iskemiske området. En strøm som går vekk fra en elektrode, gir negativt utslag i EKG. EKG blir altså egentlig mer negativt i den diastoliske fasen (fra T-bølgen foran til Q/R). Når vi ser på et EKG, vet vi imidlertid ikke hvor grunnlinjen egentlig skulle ha vært, men J-punktet som avslutter QRS, er som regel nær den «egentlige grunnlinjen». Over iskemiområdet ser det ut som om QRST er hevet i forhold til grunnlinjen, og vi kaller det «ST-løft». Over de friske områdene vil grunnlinjen løftes opp, og vi får bilde av et nedsunket QRST («resiprok ST-senkning»). Det må understrekes at ST-løft og ST-senkning ikke er ensbetydende med celledød; iskemien må pågå en tid for å gi nekrose. ST-løft i EKG er derfor et alarmsignal som skal utløse øyeblikkelige tiltak for å begrense iskemitiden mest mulig, og dermed begrense nekrosedannelsen i myokard. ST-løft-infarkt (ST-elevation myocardial infarction, STEMI) skjer oftest ved lukning av en epikardiell kranspulsåre som følge av akutt koronar trombose, men kan også ses ved spasmer i koronararteriene, såkalt variant angina (Prinzmetals angina), som særlig rammer yngre røykende kvinner.
Angina pectoris er et klinisk bilde, typisk med anstrengelsesrelaterte brystsmerter som lindres av hvile og av nitroglyserin. Det skyldes som regel iskemi, og som oftest er det EKG-forandringer mens smertene står på. Men begrepene overlapper ikke: en pasient kan ha angina pectoris uten påvisbar iskemi, og det kan være iskemitegn i EKG uten at pasienten har anginasmerter (stum/stille iskemi).
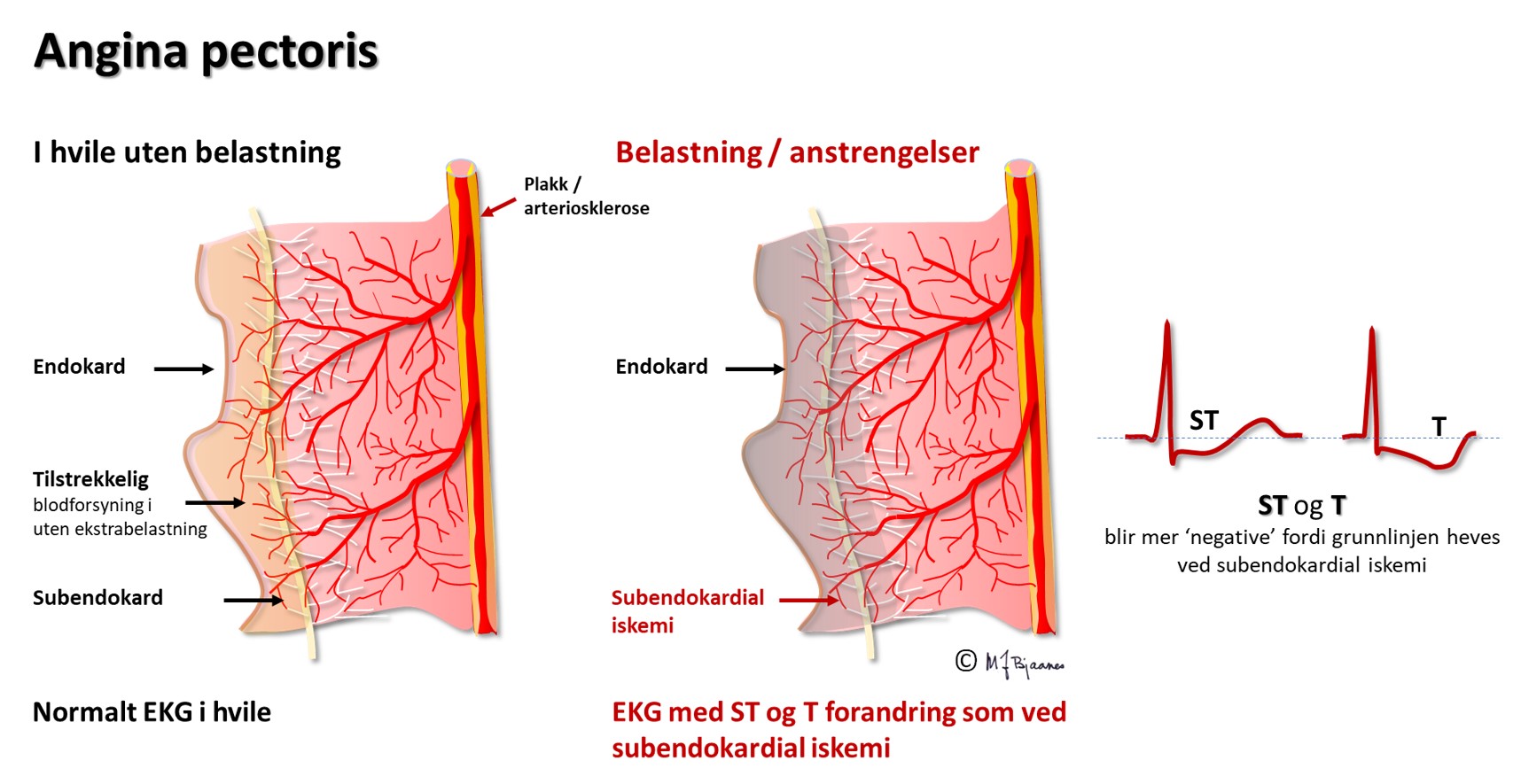
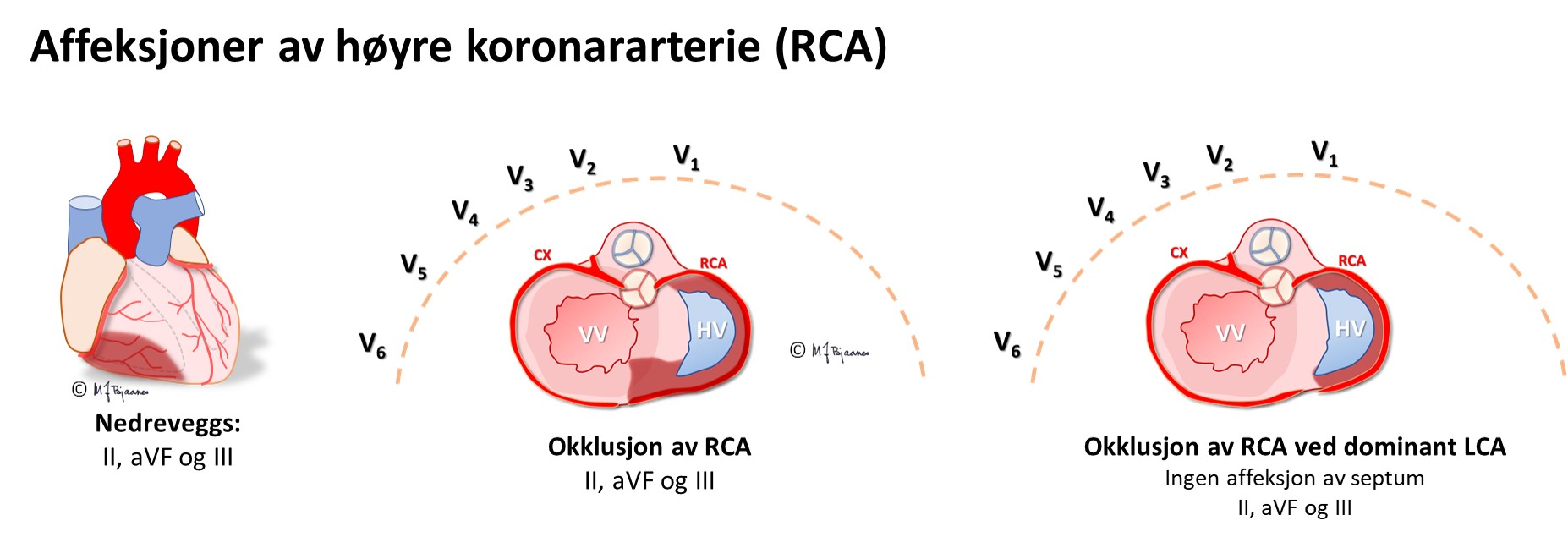
Koronararteriene ligger på utsiden av hjertemuskelen, hvor de unngår avklemming i systolen. Derfra tar de korteste vei inn mot endokard, så ved lavt perfusjonstrykk vil de dyptliggende muskelcellene i subendokard rammes først. Hvis bare endokard er iskemisk, vil cellene her få et mindre negativt hvilemembranpotensial enn cellene nærmere epikard og i det omgivende vevet. I diastole vil det derfor gå en strøm fra endokard mot epikard og den EKG-elektroden som ligger over. I EKG ser vi dette som en senkning av ST-stykket (ST-senkning) over området av hjertet som er rammet av iskemi. Slik iskemi kan ses ved en delvis lukket koronararterie (Figur 12) som gir iskemi og ev. nekrose begrenset til endokard (non-ST-elevation myocardial infarction, NSTEMI), eller fremprovoseres ved arbeids-EKG (AKG). ST-senkningen under arbeidsbelastning er som regel tydeligst i brystveggsavledningene V3-V6, men kan dessverre ikke brukes til å si hvilken koronararterie som er rammet, slik man kan ut fra de spontane endringene under STEMI eller NSTEMI.
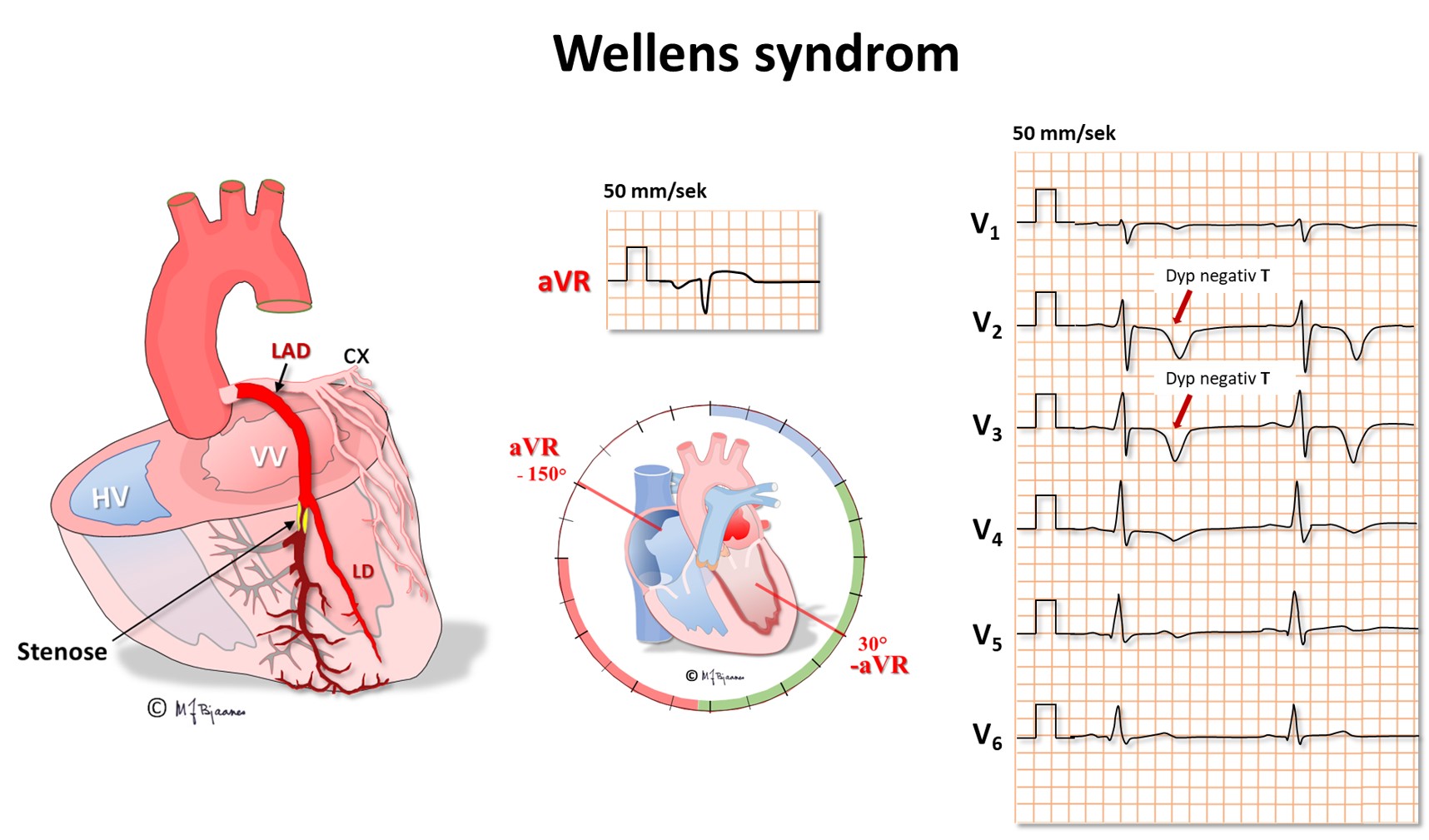
Avledningen aVR er spesiell ved at den «ser hjertet» ovenfra og ned mot endokard i mange retninger. Ved en kritisk, proksimal stenose i ramus descendens anterior (eng.: Left Anterior Descending, LAD) hender det derfor at det første tegnet i EKG er dype, spisse og symmetriske T-bølger i V2-V4. Det er ingen ST-vektor fordi skadestrømmen spres i mange retninger, men repolariseringen samles til de særpregete T-bølgene (Wellens syndrom). Dette er forvarsel om et stort forveggsinfarkt, og derfor må slike anginapasienter umiddelbart utredes med tanke på utblokking av LAD.
Et hjerteinfarkt starter med iskemi, og når iskemien har vart lenge nok, tilkommer celledød (infarkt). I startfasen er det ofte ST-løft (STEMI) eller senkning (NSTEMI) i minst to naboavledninger.
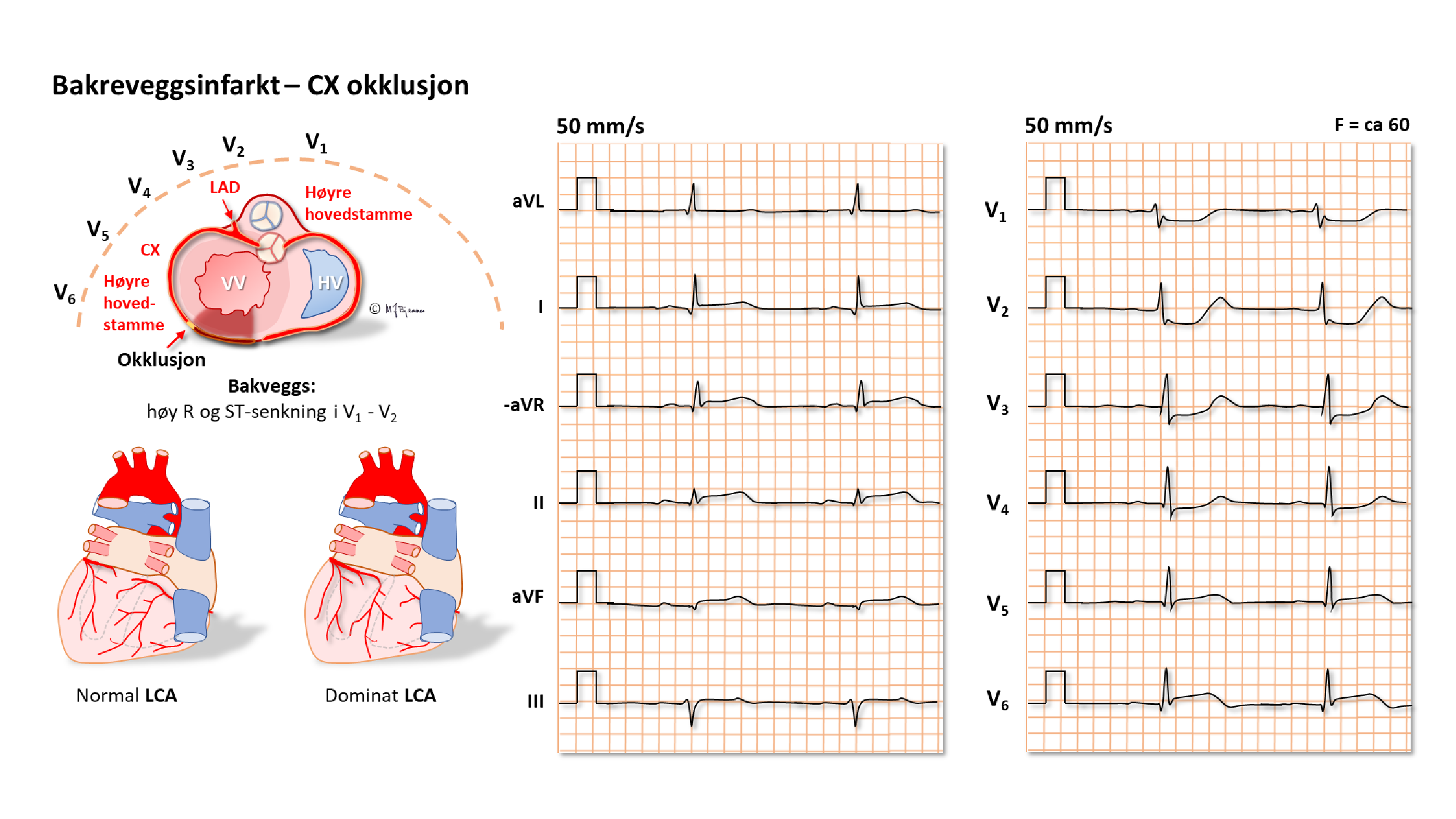
Det kan også være speilbildeforandringer i motstilte avledninger. Slike resiproke forandringer kan f.eks. ses ved transmuralt infarkt i hjertets bakvegg: det er ingen avledning som kan vise ST-hevning her, men speilbildet, ST-senkning over en frisk forveggs V2-V4, viser iskemien. Bildet ville ha vært tilsvarende ved subendokardiell iskemi i forveggen.
Celledød vises ved manglende elektrisk aktivitet i et område, dvs. som patologiske q-takker eller som nedklippede R-takker, og i tillegg snus gjerne T-bølgene. Iskemi og myokardnekrose (hjerteinfarkt) kan derfor ha ulike uttrykksformer i EKG; det hender til og med at EKG kan være normalt (lite infarkt eller motstilte infarktområder der de elektriske impulsforandringene balanserer hverandre).
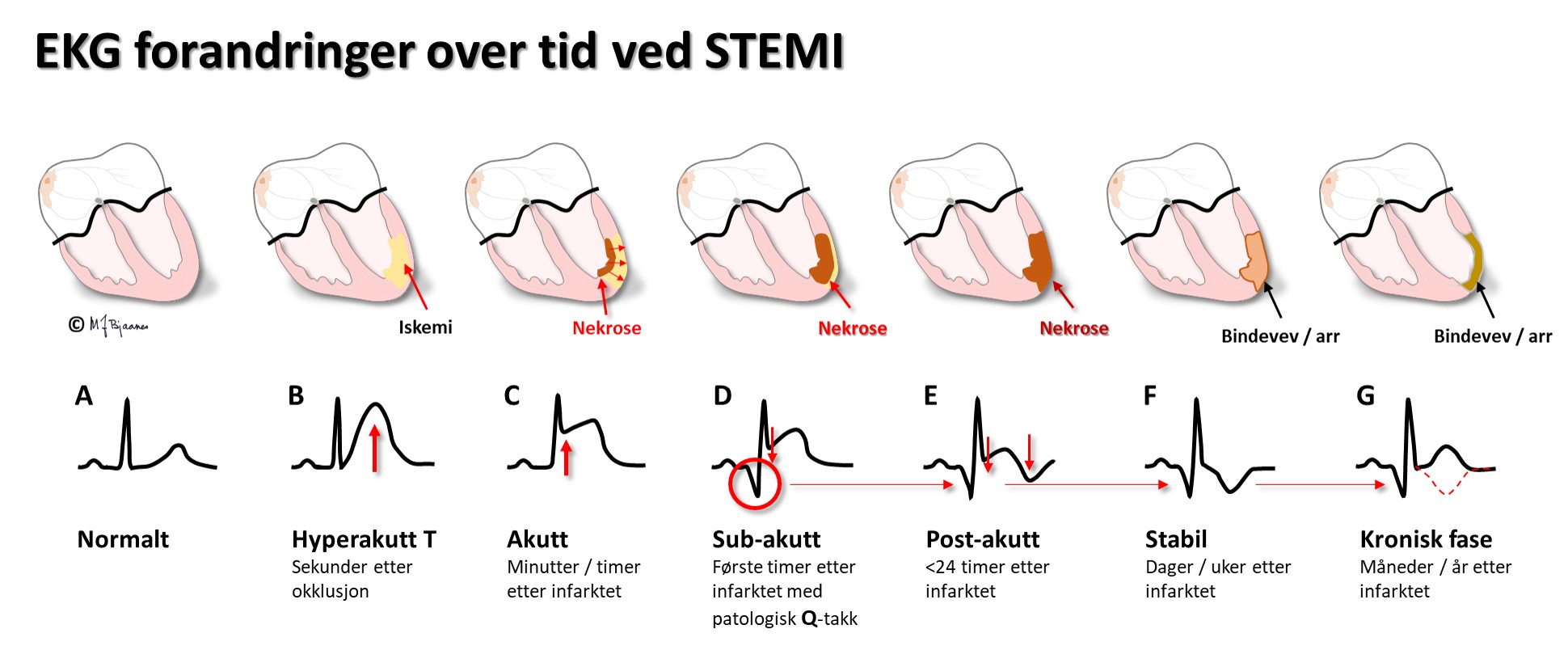
Et STEMI har et fast utviklingsmønster i EKG: aller først kan det være T-bølgeforandringer (B), så følger ST-løft (C), så utvikling av patologiske Q-takker (D) og T-bølge-inversjon (E), deretter faller ST-løftet ned, R-takken reduseres, mens Q-takk og T-inversjon utvikles videre (F), og sluttresultatet er som regel patologiske Q-takker, redusert R og ev. invertert T i skadeområdet (E).
Stabilt koronarsyndrom gir ikke ST-T-forandringer i hvile, men bare ved pågående iskemi, som kan være stum eller gi symptomer fra brystet (angina pectoris). Belastnings-EKG kan brukes for å avdekke iskemiske forandringer.
Dersom en person med stabil angina pectoris har QRS-endringer (patologiske Q-takker, fragmenterte QRS eller reduserte R-amplituder) i minst to naboavledninger, er det sannsynlig at vedkommende tidligere har gjennomgått et hjerteinfarkt.
Ut fra EKG klassifiseres akutt koronarsyndrom (ACS) STE-ACS (med ST-Elevation) eller NSTE-ACS (non-STE, uten ST-hevning).
Ved STEMI er årsaken gjerne en plutselig lukket stor (epikardiell) koronararterie, og så lenge det er ST-løft eller senkning, er det liv i iskemiske celler som ofte kan reddes ved gjenåpning av arterien (trombolyse eller PCI). Pasienter med pågående smerter og nyoppstått ST-løft skal derfor hurtigst mulig ha behandling, selv om det er gått atskillige timer siden smertestart; en trombe kan vokse og avta, og det kan ha vært perioder med noe perfusjon som har forlenget det terapeutiske vinduet.
Den fjerde universelle definisjonen av hjerteinfarkt (2018) sier at i den rette kliniske sammenheng tyder følgende EKG-forandringer på et pågående infarkt: Nye ST-elevasjoner fra J-punktet i minst to naboavledninger, med >0,1 mV løft (gjelder alle avledninger bortsett fra V2- V3, der det normalt kan være litt ST-løft, og derfor har grensen på ≥0.2 mV hos menn ≥40 år, ≥0.25 mV hos menn <40 år, og ≥0.15 mV hos kvinner). Det forutsettes fravær av venstre grenblokk og venstre ventrikkelhypertrofi. Infarkt er også sannsynlig ved nyoppstått horisontal eller nedadgående ST-senkning > 0,5 mm i to naboavledninger og/eller T inversjon > 1 mm i to naboavledninger med høy R-bølge og eventuell R/S ratio > 1.
En EKG-elektrode som er plassert rett over et iskemisk område, vil vise ST-løft, og derfor vil startfasen av et STEMI ha en ST-vektor som peker på det skadete området i hjertet. Ut fra hvilke avledninger som har ST-hevning, kan en derfor som regel gi et kvalifisert forslag om hvilken kransåre som er lukket. Siden pasienter som undersøkes for iskemisuspekte smerter, ofte har flere koronararterier med aterosklerose, har EKG-funnene betydning for å avgjøre hvilke arterie som har «fersk» trombose og derfor er årsaken til den akutte episoden. Summen av mm ST-løft fra alle de 12 avledningene gir dessuten en indikasjon om størrelsen av det infarkttruede området. Sammen med lokalisasjonen gir dette tips om hvilke komplikasjoner man kan forvente og være ekstra oppmerksom på i akuttforløpet.
Lokalisering av infarktet ut fra ST-løftet:
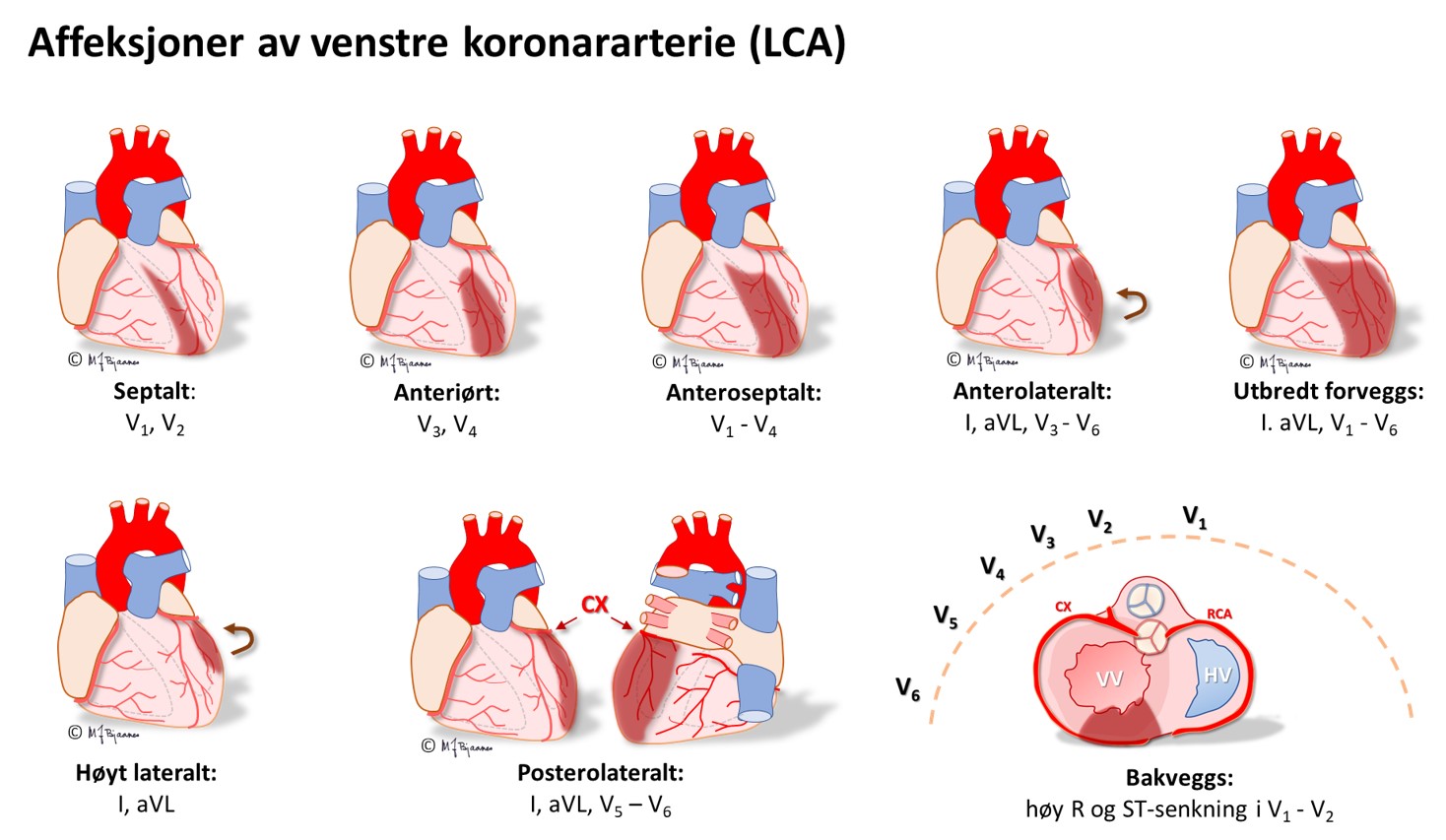
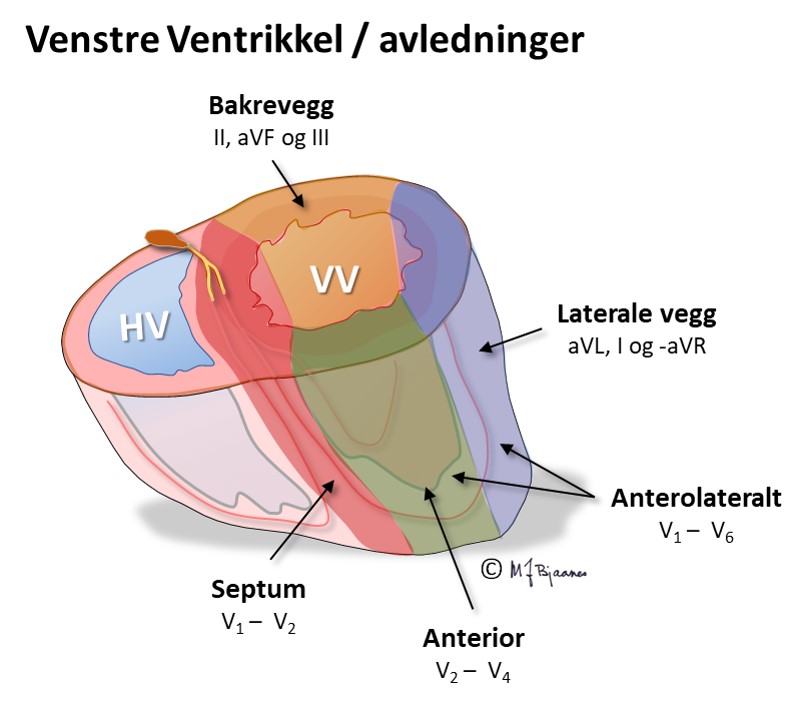
HUSK: Et EKG tatt tidlig i forløpet av et infarkt, kan være normalt. Hvis det er klinisk sterk infarktmistanke, ta nytt EKG med en halvtimes mellomrom de første par timene; ikke sjelden kommer infarktforandringene gradvis
HUSK: Sammenlikne med tidligere EKG hvis det er mulig (men ikke kast bort tid med det)
HUSK: Venstre grenblokk kan maskere et STEMI. Infarktsuspekt klinikk med nyoppstått v. grenblokk skal derfor behandles som et STEMI
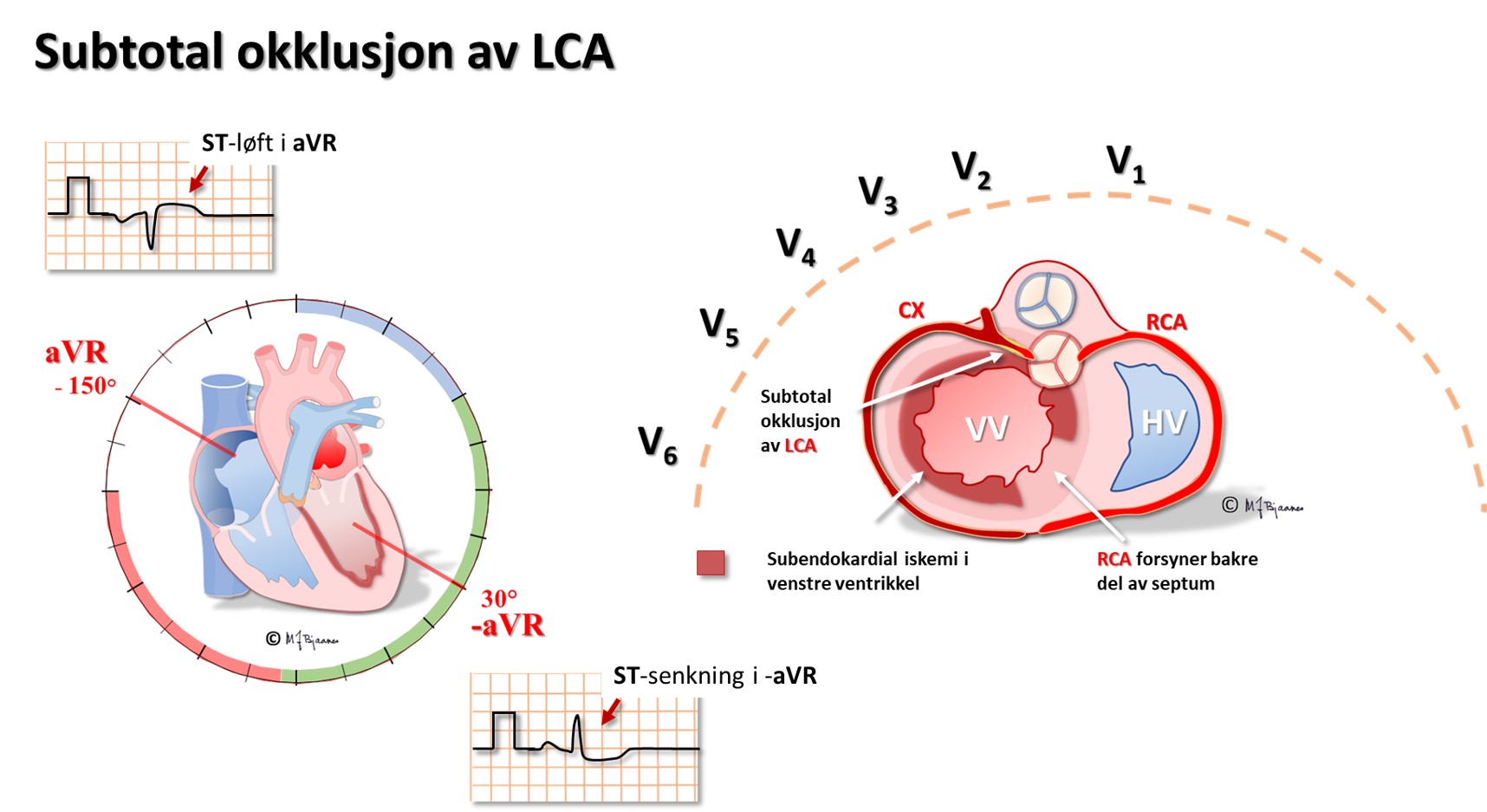
Subtotal okklusjon av venstre hovedstamme gir global iskemi av subendokard i nesten hele venstre ventrikkel, og når hovedstammen lukkes helt, blir det raskt utvikling av infarkt og hjertesvikt. aVR, som «ser rett ned i» hjertekammeret, får ST-løft, mens prekordialene V3-V6 og standardavledningene I og aVL får markerte ST-senkninger. Proksimal LAD-stenose er blitt kalt «the widow maker», og okklusjon kan gi et liknende bilde, men da er som regel ST-løftet i aVR mindre enn det er i V1.
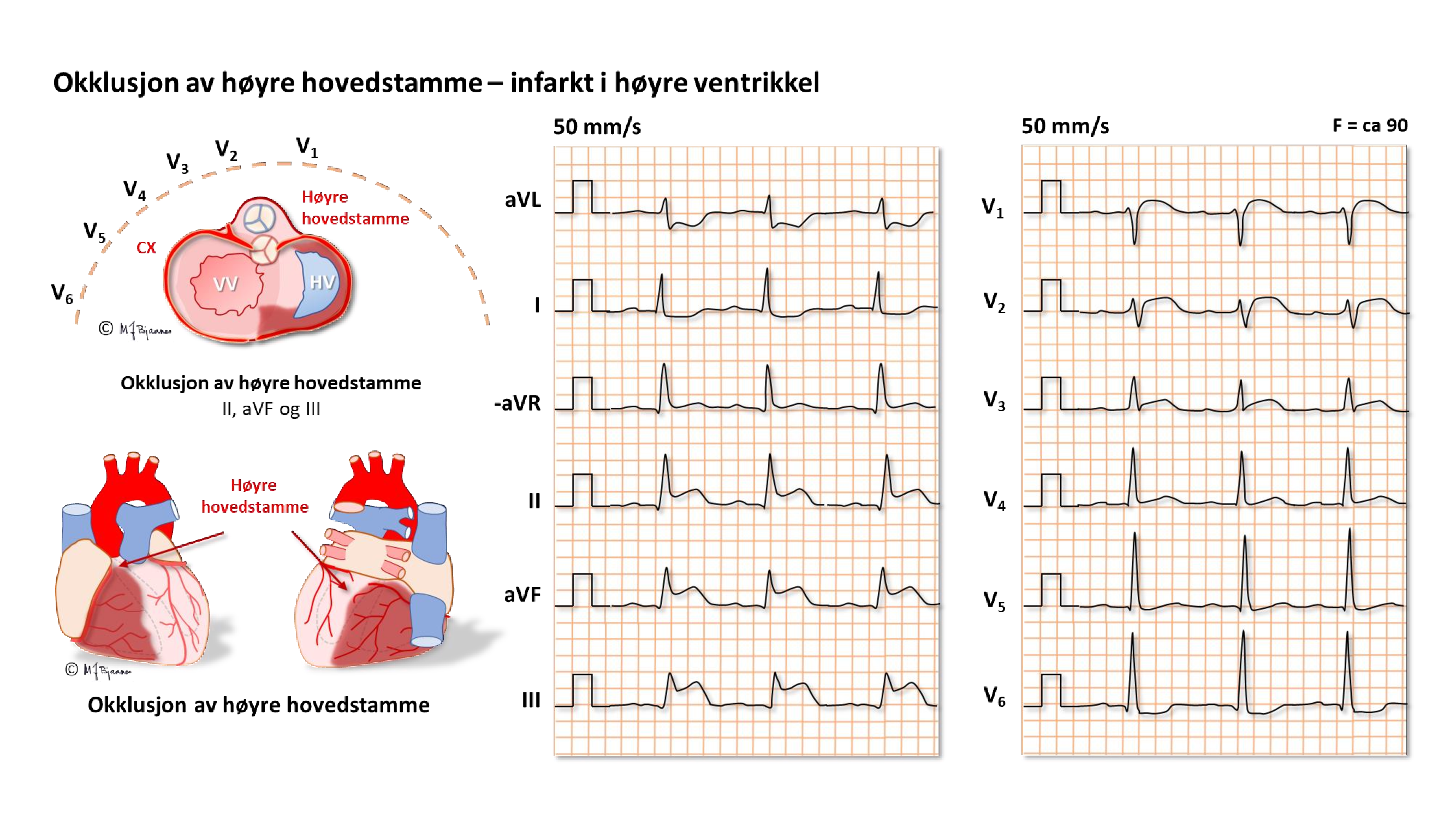
Ved kort sykehistorie/pågående smerter og nedreveggs-STEMI: ta speilvendt prekordial-EKG. RV3-4 kan da vise et tidlig, men kortvarig ST-løft (tynn vegg gjør at skaden raskt blir transmural, cellene dør, og så normaliseres ST-segmentet).
EKG kan ofte skille en okkludert ramus circumflexus (CX) fra en okkludert høyre koronararterie (RCA). Dette er viktig på angiografilaboratoriet fordi ramus descendens posterior noen ganger kommer fra circumflex (venstredominans), men oftest fra høyre koronararterie (høyredominans). De to pulsårene krever hver sin form på kateteret som brukes til å stake opp og blokke okklusjonen.
Ved NSTEMI
Da har man troponinøkning + kliniske symptomer og/eller EKG-forandringer
som Q-utvikling, ST-senkning eller T-bølgeforandringer. Ved
ekkoundersøkelse kan en ofte se mer stillestående områder, men det kan
være vanskelig å skille mellom gamle og ferske forandringer.
Et infarkt kan overses NÅR UTGANGS-EKG er unormalt
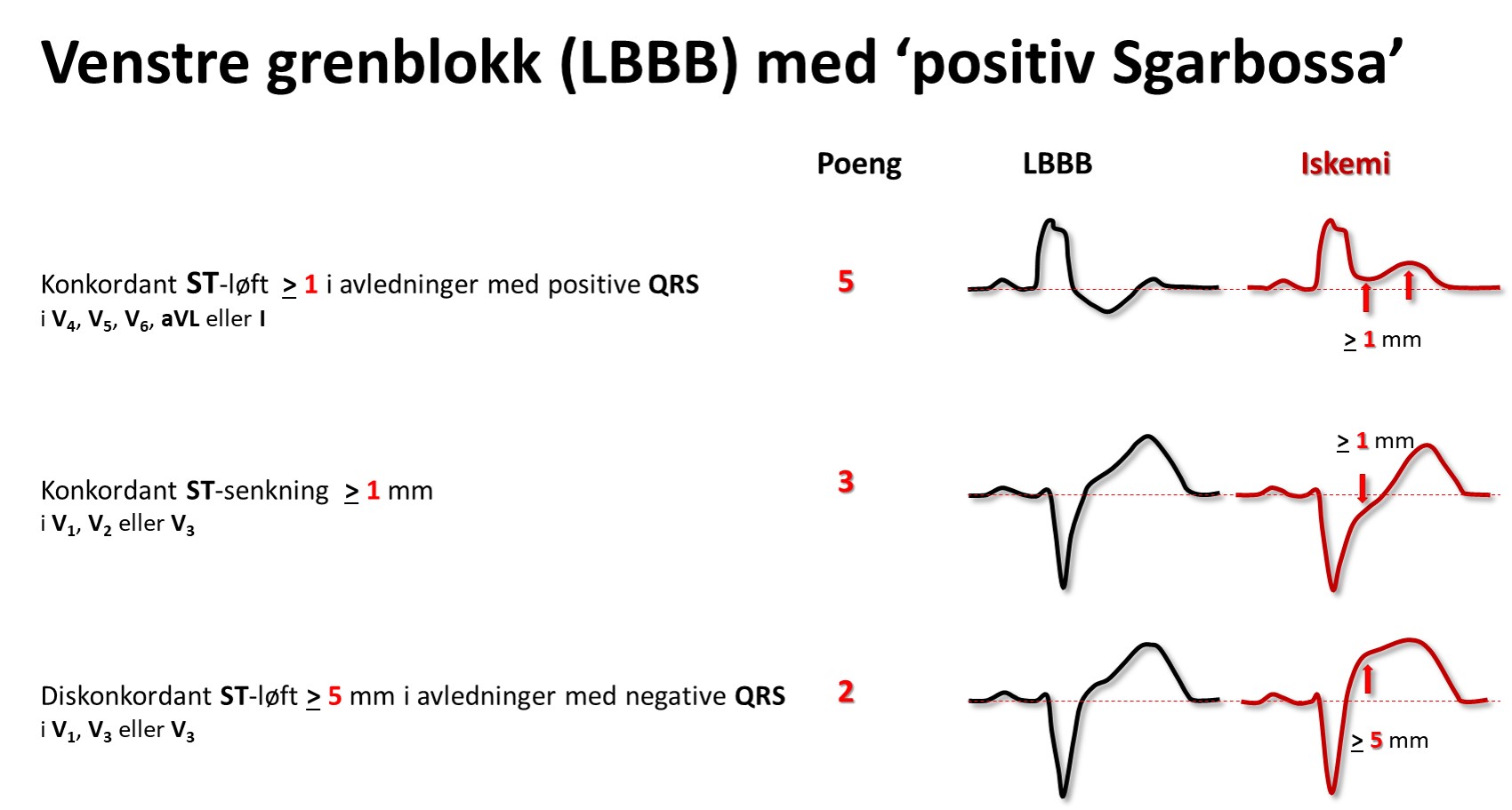
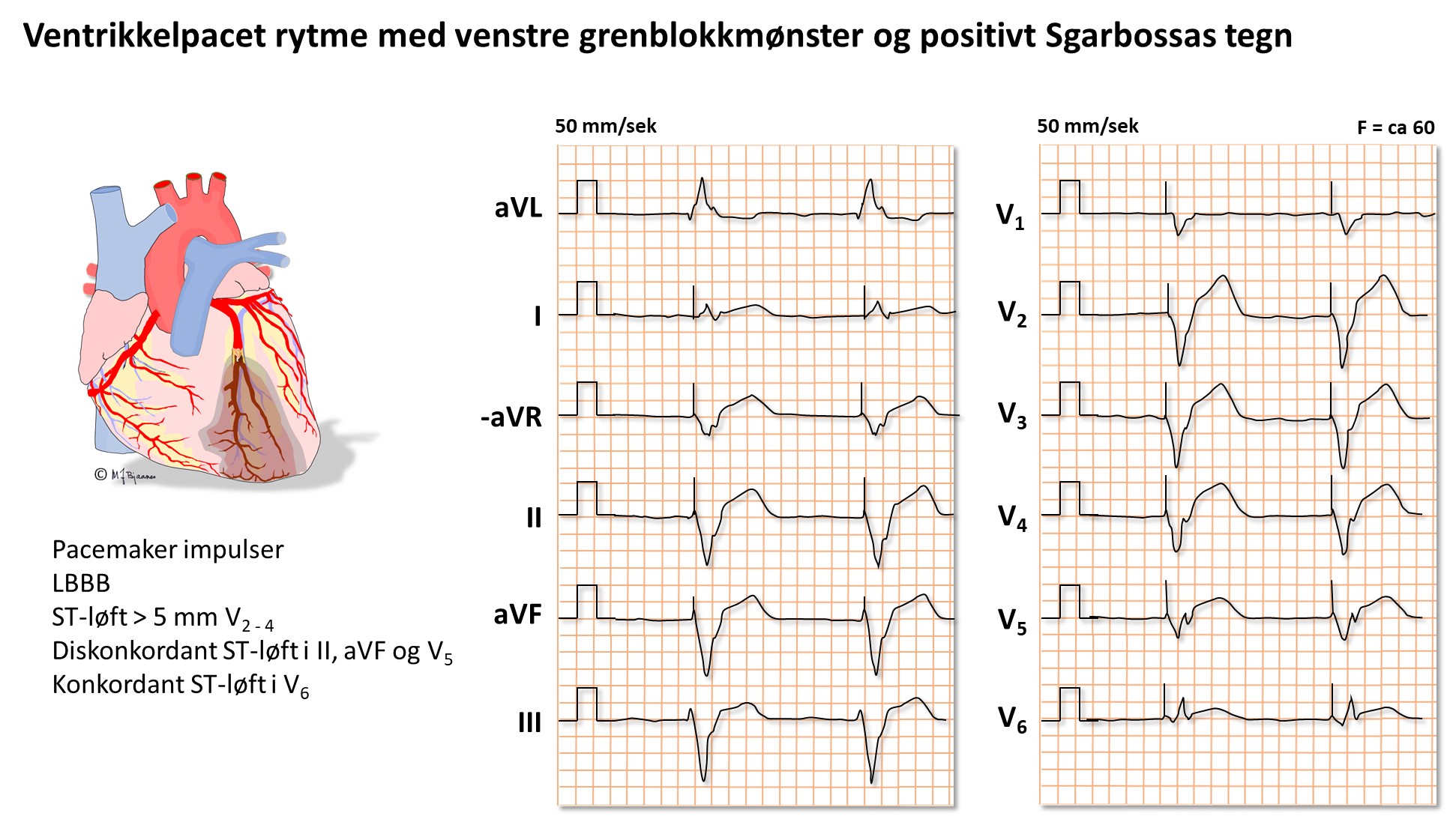
Ved venstre grenblokk (LBBB) peker som regel ST-avviket og T-bølgen vekk fra hovedutslaget i QRS; de er diskordante. Et konkordant ST-avvik og/eller T-bølge ved venstre grenblokk gir mistanke om et pågående infarkt, og likeså et ST-løft på > 5mm (såkalte Sgarbossakriterier). Men ofte er det vanskelig å skille gammelt fra nytt før troponiner er analysert.
Et infarkt kan også feilaktig mistenkes når det er
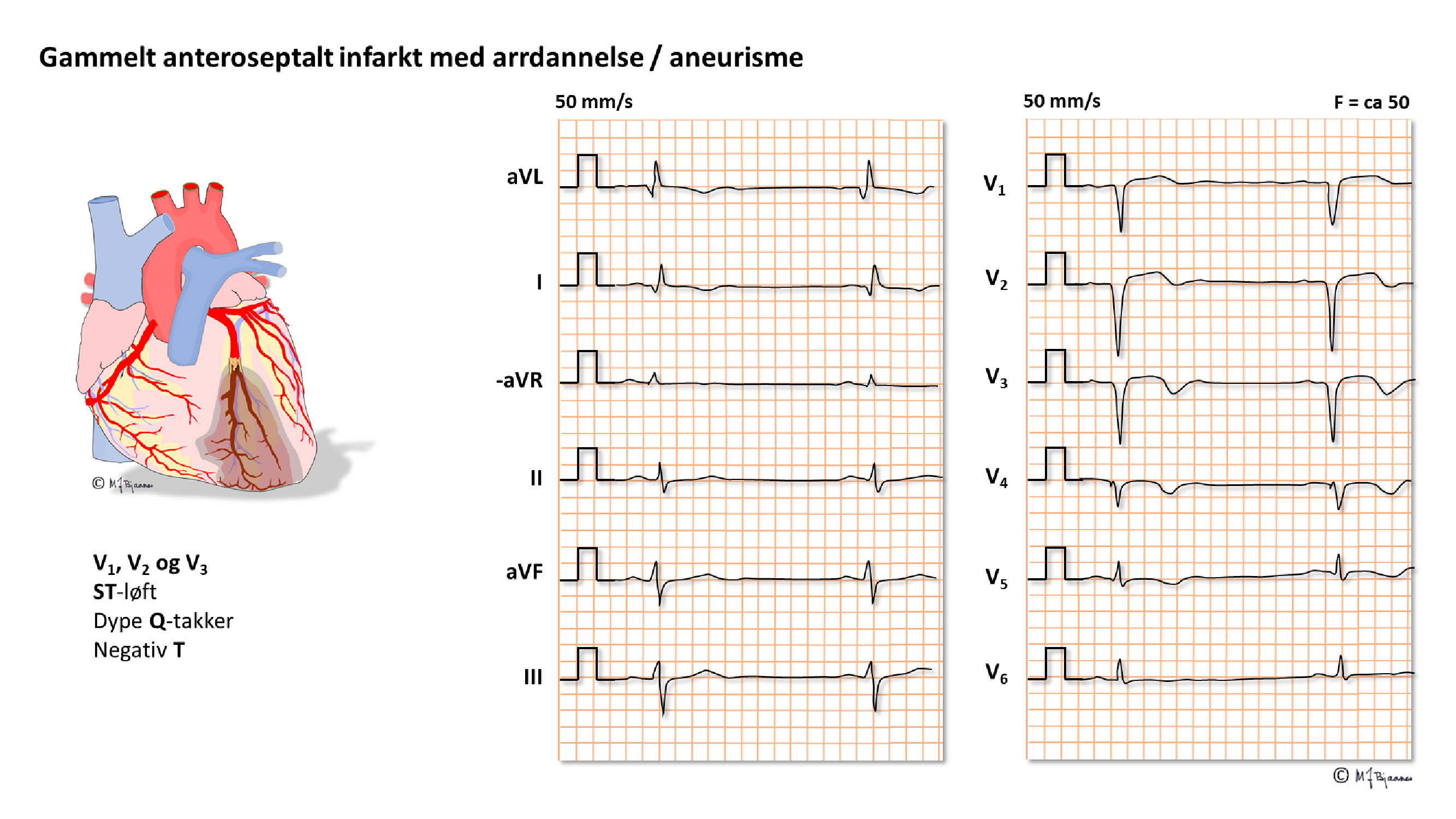
Gamle hjerteinfarktforandringer
Patologiske q-takker er det viktigste kjennetegnet på et gjennomgått hjerteinfarkt. Fra Del 2 repeteres:

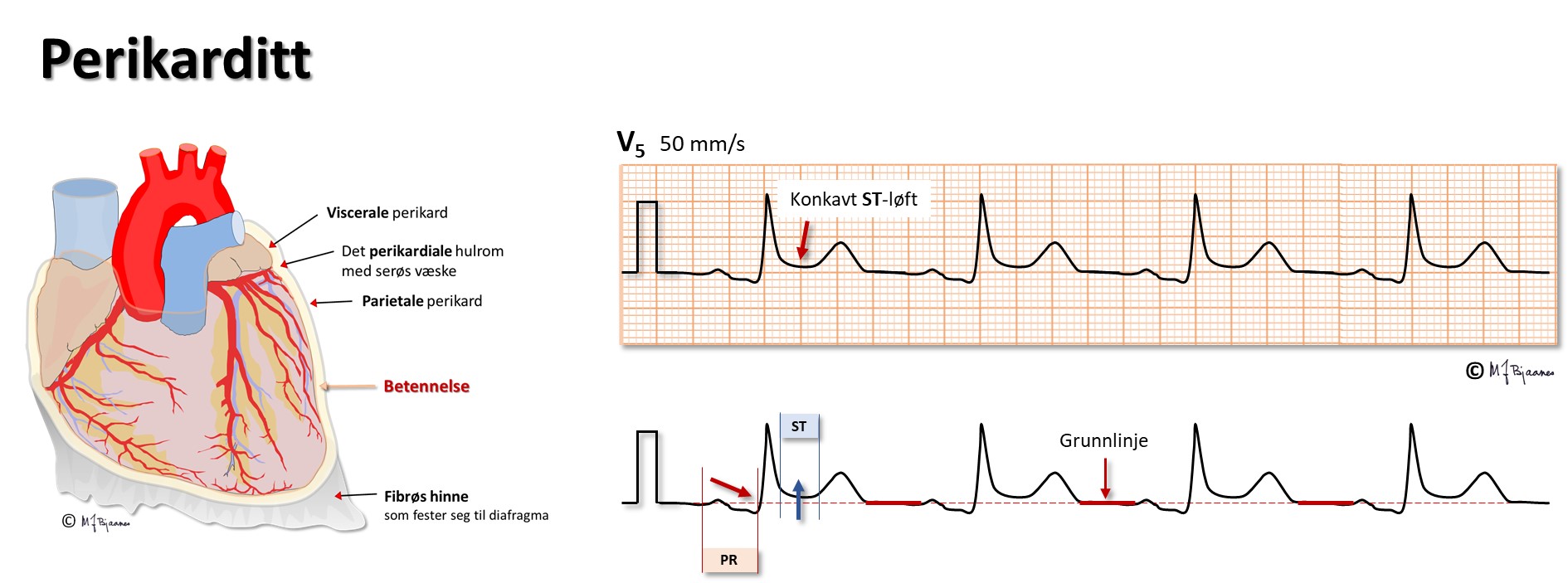
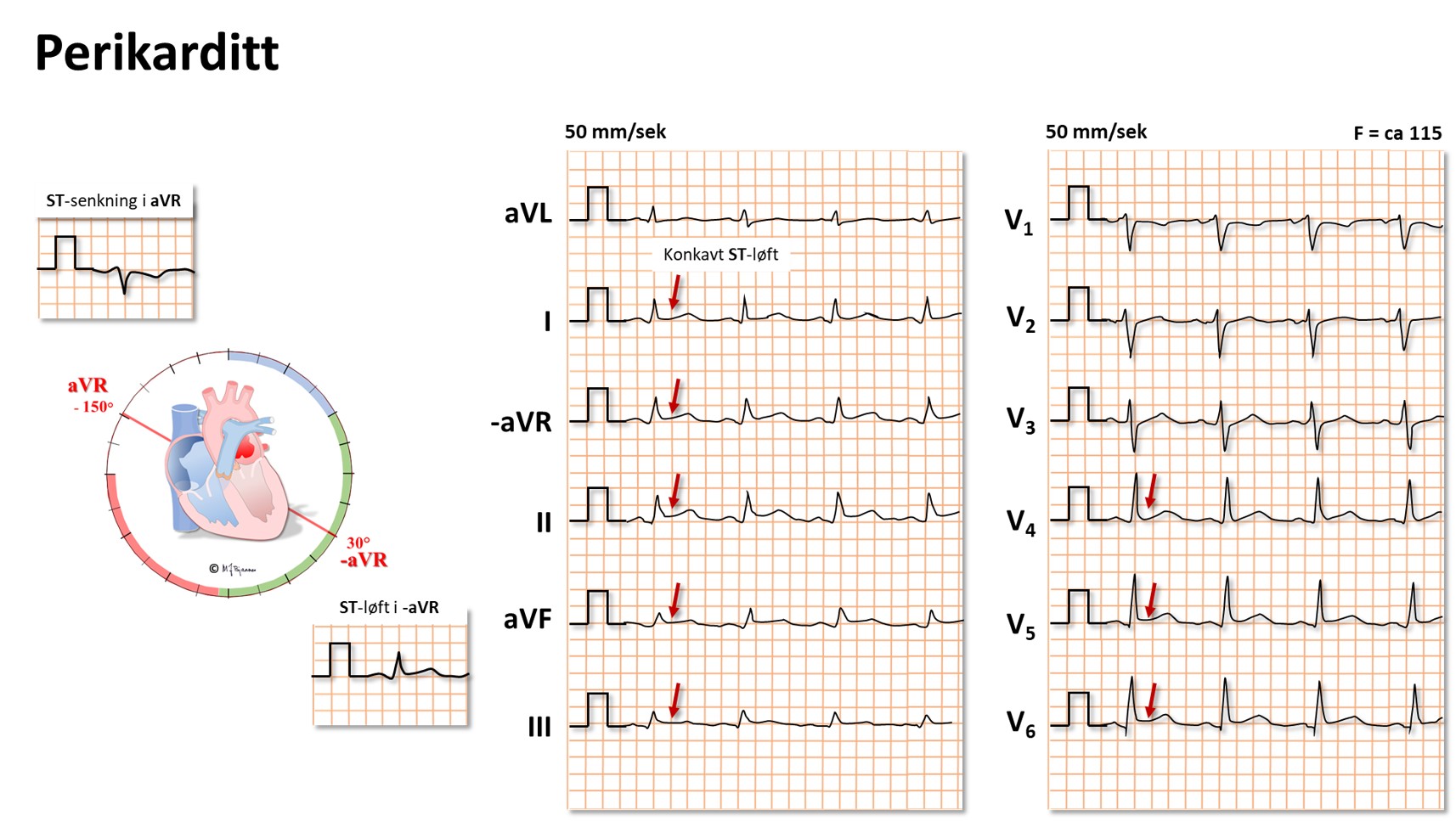
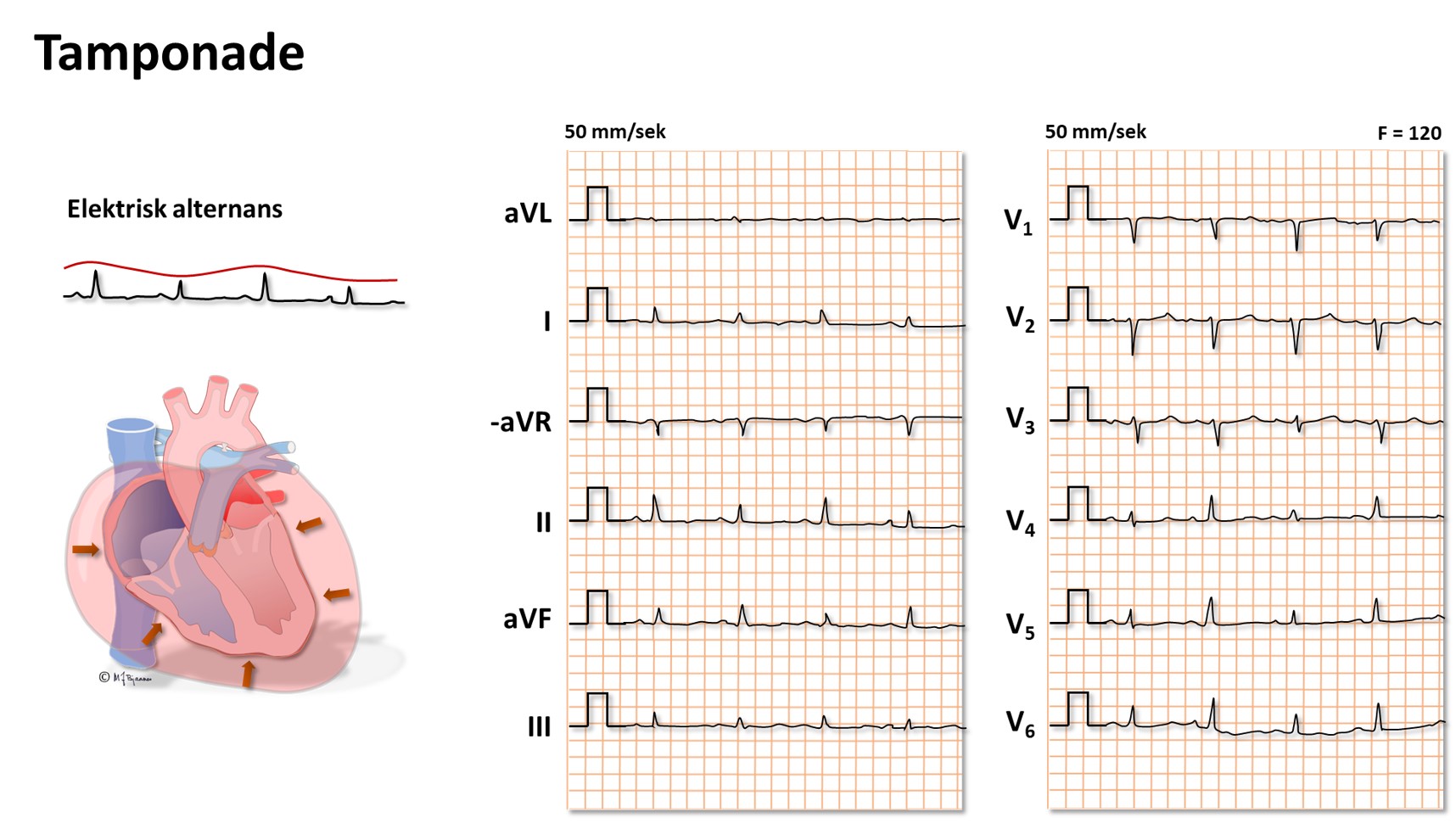
Hvis det er mye væske i perikardhulen (betennelse, blødning), kan hjertets fylning bli hindret av det uelastiske perikard. Dette gir et karakteristisk klinisk bilde, og EKG forandres:
Hos en tungpustet pasient må en raskt finne ut om det er hjertet eller lungene som er hovedproblemet, men aldri glemme muligheter som feber, anemi, hyperventilasjon, tyreotoksikose m.m. Det er sjelden at EKG er helt normalt ved hjertesvikt.
Ved hjertesvikt kan problemet skyldes plutselig oppstått altfor rask eller langsom puls, eller noe for rask, langsom eller uregelmessig puls gjennom lengre tid. Pasienter med totalt AV-blokk og langsom erstatningsrytme, og de med nylig oppstått raskt overledet atrieflimmer, er slike eksempler.
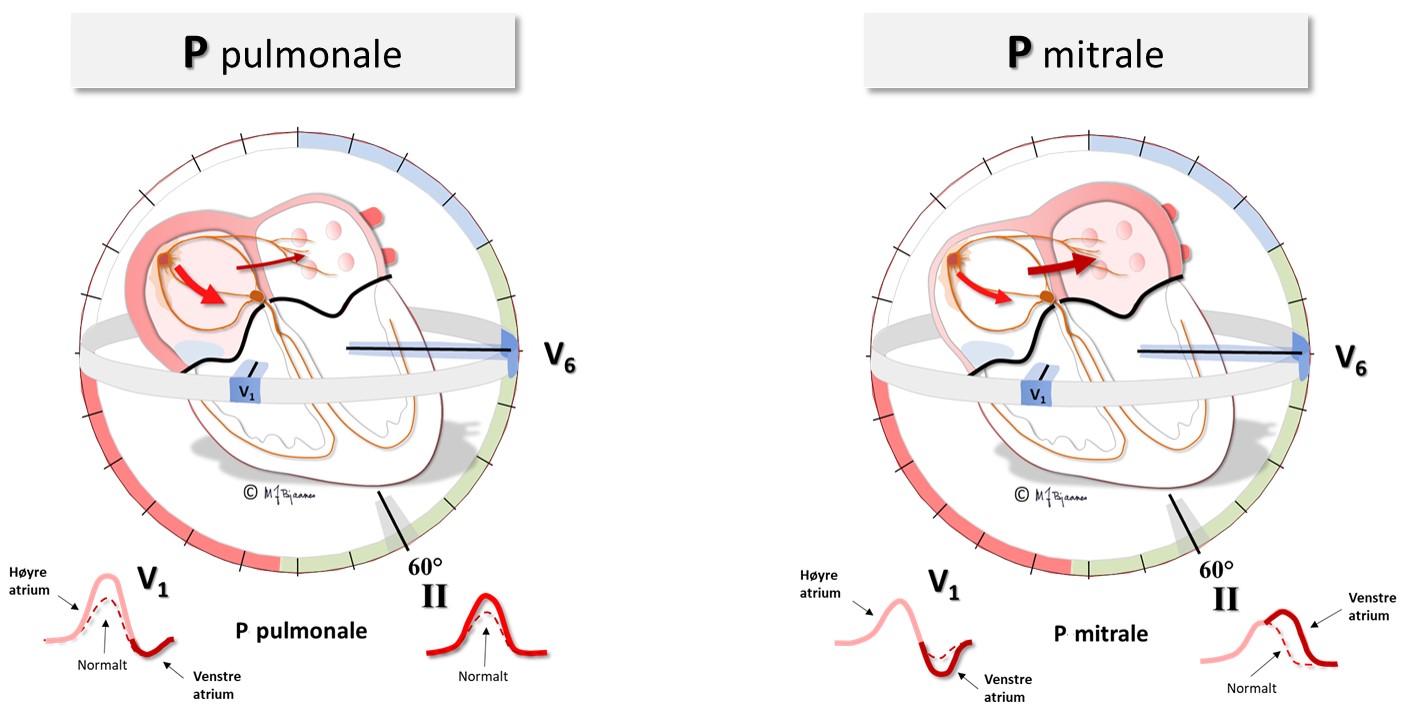
Ved svikt i venstre hjertekammer rammes ofte diastolen først, så hjertet blir stivere og tyngre å fylle. Dette gir økt størrelse og veggstrekk i venstre atrium: P-bølgen blir bredere (>0,12 s), og siste del av P i V1, som viser venstre atrium, blir negativ fordi sluttaktiveringen går bakover mot venstre. Det er patologi når en negativ P-terminale i V1 måler ≥40 (produktet av negativ varighet i ms og maksimal negativ amplitude i mm ved standard forsterkning). I praksis betyr det ≥ 3 mm varighet av P og ≥ 2 mm varighet og ≥ 1 mm dybde. Aller mest uttalt kan det bli ved mitralstenose: da kan P-bølgen bli to-puklet og likne bokstaven M («P Mitrale»).

Ved hjertesvikt dilateres som regel hjertekamrene; de blir mer blodfylte, og fordi strømledningen i blod er dårligere enn i kroppsvev, blir QRS-utslagene ofte redusert. Koronar iskemi kan vises ved avvik i ST-segmentet og/eller T-bølgene. Gamle hjerteinfarkt kan vises ved patologiske Q-takker i minst to naboavledninger, eller mistenkes ved fragmenterte QRS eller inverterte T-bølger. Erstatning av myokard med fibrose kan også mistenkes ved brede QRS uten grenblokkmønster (såkalt intraventrikulært ledningshinder). Normalt har V5 den største R-amplituden, men ved sterkt utvidet venstre ventrikkel, ligger apex gjerne forbi V6, og en elektrode i bakre aksillelinje (en V7) kan da ofte vise en enda større R. Koordineringen av septumbevegelsene er mest forstyrret ved venstre grenblokk.
Ved en plutselig tilstopning av lungearterier vil det bli en
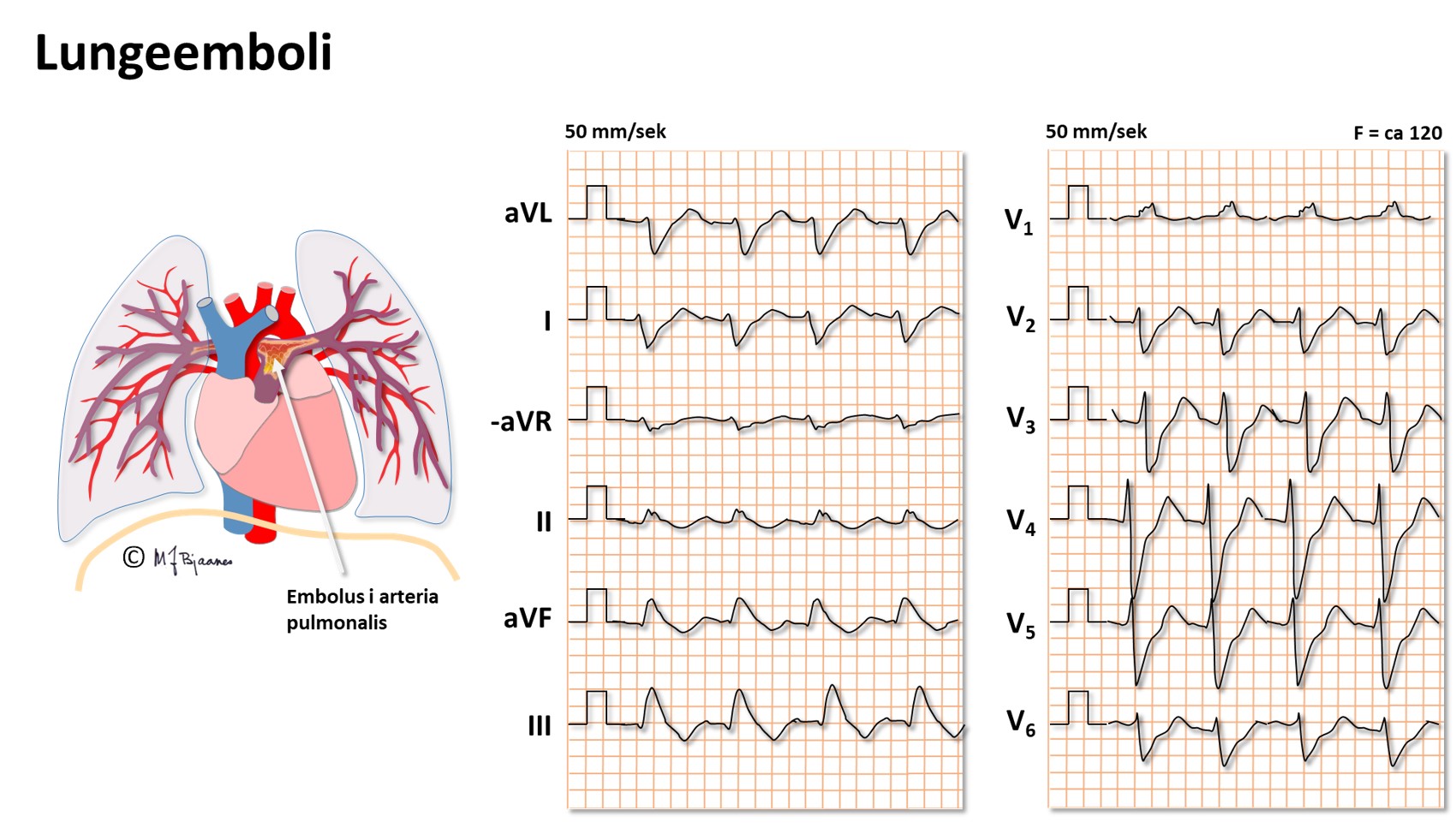
Her: Sinustakykardi, høyre grenblokk (RBBB), negativ T i III, medurs rotasjon av QRS-aksen
Ofte ses også:høyre aksedeviasjon + dominant R i V1, høyre
atrieforstørrelse (P pulmonale), atriale takyarytmier – atrieflimmer,
atrieflutter eller atrietakykardi.
Kronisk høyt trykk i det lille kretsløpet kan skyldes forplantning av høyt trykk fra en sviktende venstre hjertehalvdel, økt arteriolemotstand (primær pulmonal hypertensjon), være en følge av arterietilstopping (kronisk embolisme), eller skyldes økt blodstrøm i det lille kretsløp på grunn av en venstre til høyre shunt.
Høyre ventrikkelhypertrofi vil vises ved ett eller flere tegn, som

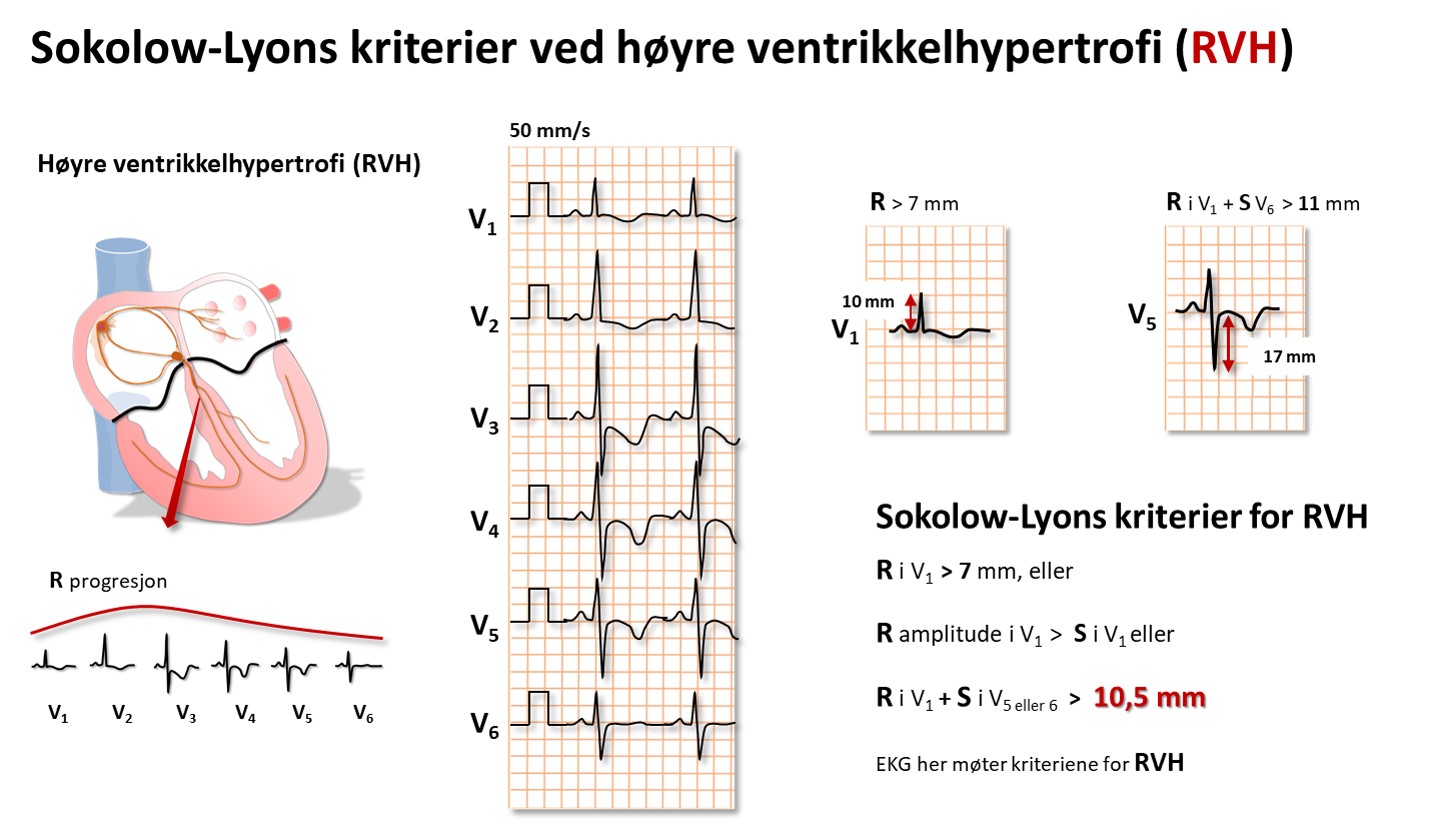
Sokolow-Lyon (R i V1 + S i V5 eller 6 > 10,5 mm), høyre akse(deviasjon), P pulmonale, ofte inkomplett RBBB
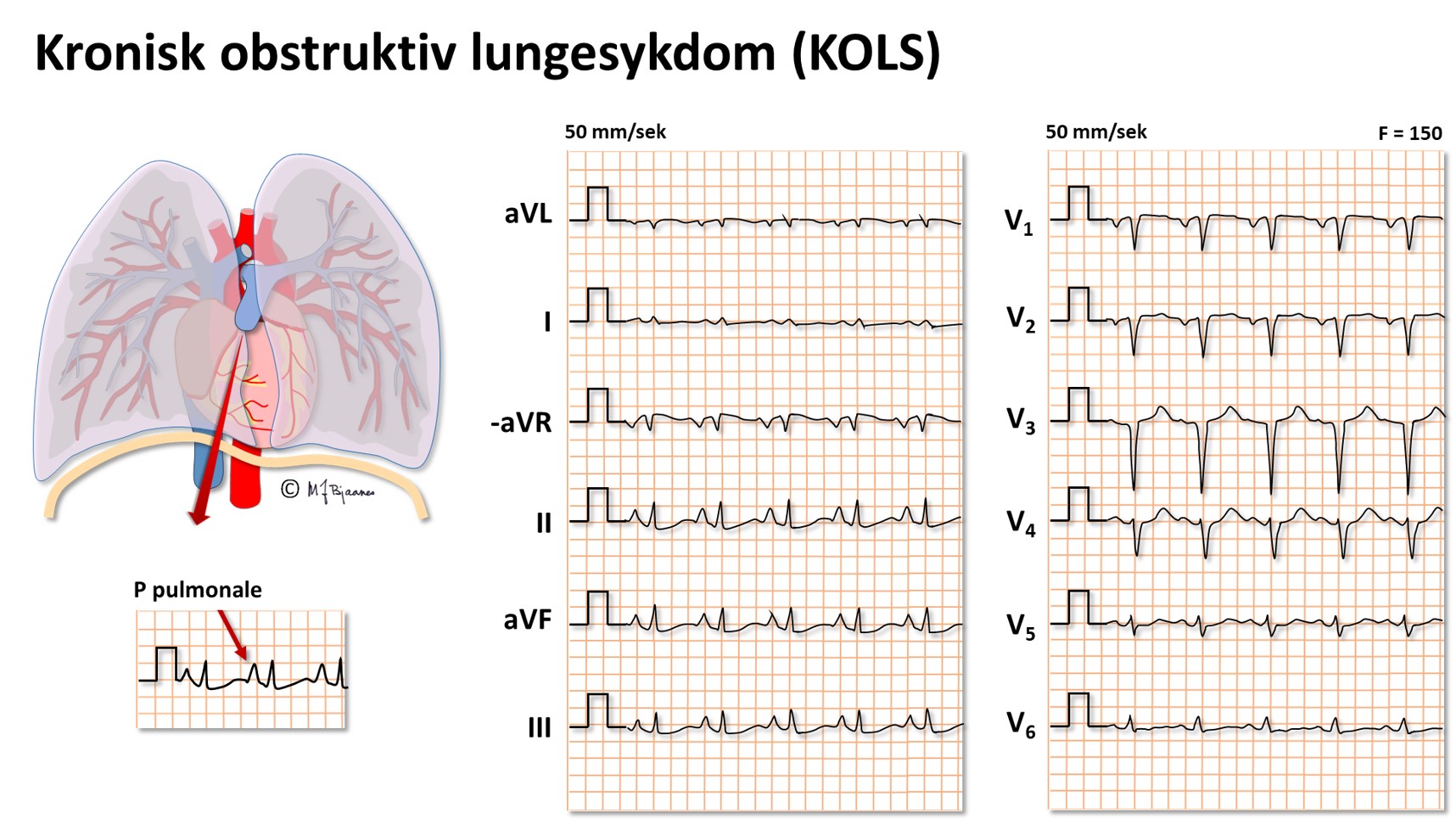
Ved KOLS er det gjerne komponenter av astma, bronkitt og emfysem som hver for seg kan påvirke hjertet og EKG forskjellig. Emfysemet gir svinn av lungevev, så brysthulen utvides og hjertet blir anatomisk mer vertikalt stilt. Det kan bli høyresidig hypertrofi på grunn av det økte arbeidet med å presse blodet gjennom lungekar som gir mer motstand. Septum kan (anatomisk) rotere medurs fordi høyre kammer blir utvidet, så den prekordiale rS-til-Rs-overgangen forskyves mot aksillen, eller aksedreiningen kan bli motsatt, moturs og mot høyre på grunn av høyrehypertrofi. Økt lungekarmotstand kan redusere tilbakestrømmen av blod til venstre side, og den kroniske reduksjonen av preload gir svinn av muskelmasse og elektrisk aktivitet her. De ekstra godt luftfylte lungene pakker seg rundt hjertet, og ettersom luft har høy elektrisk motstand, blir QRS-utslagene små. Resultanten av dette blir at EKG ved uttalt KOLS sjelden er helt normalt, men det er et heterogent bilde der sinustakykardi, vertikal P-akse (>70°), høyre hypertrofi, og enten høyre eller venstre aksedeviasjon er de vanligste komponentene.
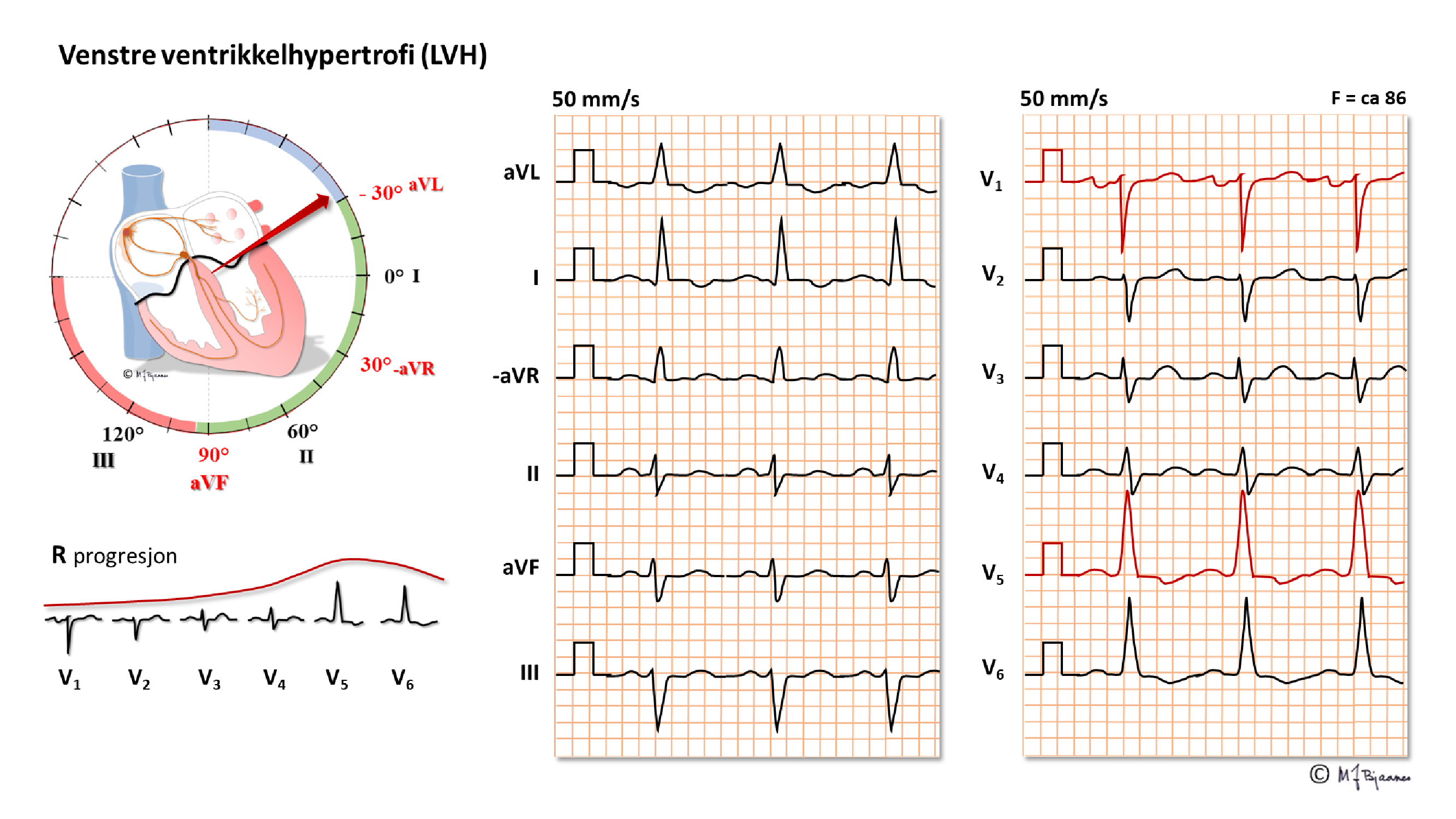
Ved venstre ventrikkelhypertrofi (VVH) har kammeret økt muskelmasse som kan påvises ved billedteknikk (ekkokardiografi, CT-røntgen eller MR-undersøkelse) eller eventuelt ved obduksjon.
Definisjonen av VVH er venstre ventrikkels muskelmasse > 116 g/m2 hos menn og > 104 g/m2 hos kvinner. Økningen kan vises ved tykkere vegg, større kammer eller de to kombinert. Sarkomerene øker i antall og størrelse i hver celle, mens celletallet ikke øker. Fysisk aktive personer har større hjertemuskelmasse enn de inaktive, og kan ha ikke-sykelig hypertrofi. Ved patologisk hypertrofi, som når venstre ventrikkel har arbeider mot forhøyet motstand (aortastenose, hypertensjon) eller har en hjertemuskelsykdom (hypertrofisk kardiomyopati), vil det i tillegg være infiltrasjon av betennelsesceller og bindevev (fibrose).
Også hos topptrente skal sykelige VVH-tegn gi mistanke om underliggende hjertemuskelsykdom.
Det finnes et stort antall diagnostiske formler for VVH-påvisning med EKG. De fleste er basert på små studier med pasientgrupper og normale kontroller, og man har brukt obduksjonsfunn, røntgen, ekkokardiografi eller MRI som fasit. Noen algoritmer vektlegger QRS-amplitudene mest, andre tar mer hensyn til remodellerings- og fibrosetegn. Gjennomgående har EKG-diagnostikken av VVH lav sensitivitet, men høy spesifisitet.
Det er ingen sterk korrelasjon mellom ekkokardiografisk påvist venstre ventrikkelmasse og EKG-målene. Det kan skyldes mange forhold: hjertekammeret har ikke den ideelle formen som masseberegningen ved ekkomåling forutsetter, og målingene er operatøravhengige. Muskelhypertrofien kan være ujevnt fordelt i hjertet. EKG på sin side er følsomt for elektrodeplassering, hudmotstand, lungevolum, hjertets plass i toraks og, ikke minst, graden av myokardfibrose. Det er derfor ikke overraskende at ekkofunn korrelerer best mot MR-funn, mens EKG er best til å angi risikoen for komplikasjoner som hjertesvikt og død.
Det er derfor viktig å kunne stille diagnosen sykelig venstre ventrikkelhypertrofi: ved hypertensjon skal behandlingen da intensiveres, ved aortastenose styrker det operasjonsindikasjonen, og en atlet kan få konkurranseforbud. For allmennlegen er derfor VVH-diagnostikk viktig.
er en følge av økt muskelmasse. Vanligvis er ikke totalt QRS-utslag (fra høyeste topp til laveste bunn) >2 mV (20 mm) i standardavledninger og/eller >3 mV (30 mm) i prekordialene. Veltrente unge, og da særlig menn, kan ha nær sagt hvor store utslag som helst, så sant det ikke er samtidige tegn på annen patologi (de har «idrettshjerte»). En rekke forhold kan imidlertid redusere QRS-utslagene og dermed maskere en ventrikkelhypertrofi:
Det blir ofte store QRS-utslag når kamrene aktiveres på unormal måte, for eksempel ved grenblokk, kammerpacing eller aktivering via en ekstra atrioventrikulær bunt (preeksitasjon).
Når muskelmassen øker, kan hjertet remodelleres både elektrisk og anatomisk, og det gir endret QRS-hovedakse. Ofte dreier den forover og gir større utslag i V1-V6, men den kan også dreie oppover og bakover. Det siste vil gi større R i aVL (opp mot venstre skulder) og dypere S i V3 (bakover).
Normalt varer QRS < 100 ms. Ved inflammasjon/fibrose vil impulsutbredelsen bli langsommere og kan gi et lett intraventrikulært ledningshinder (QRS100-120 ms). Samtidig kan R-toppen i V5-V6 bli forsinket (>50 ms fra start av q). Forsinkelse i impulsutbredelsen kan også vises som fragmentering (hakk eller pigg på R eller S).
Langsom impulsutbredelse skjer både fordi muskulaturen er tykkere enn vanlig, men særlig på grunn av fibrose. Det gir reversert repolarisering (fra endo- til epikard), som vises ved at ST-segment og T-bølge ikke er konkordante med QRS, men motstilte (diskordante). Normalt er det < 60° aksesprik mellom QRS og T, og hvis det er større, med smale QRS, skal man tenke kammerhypertrofi, gammelt hjerteinfarkt eller kardiomyopati.
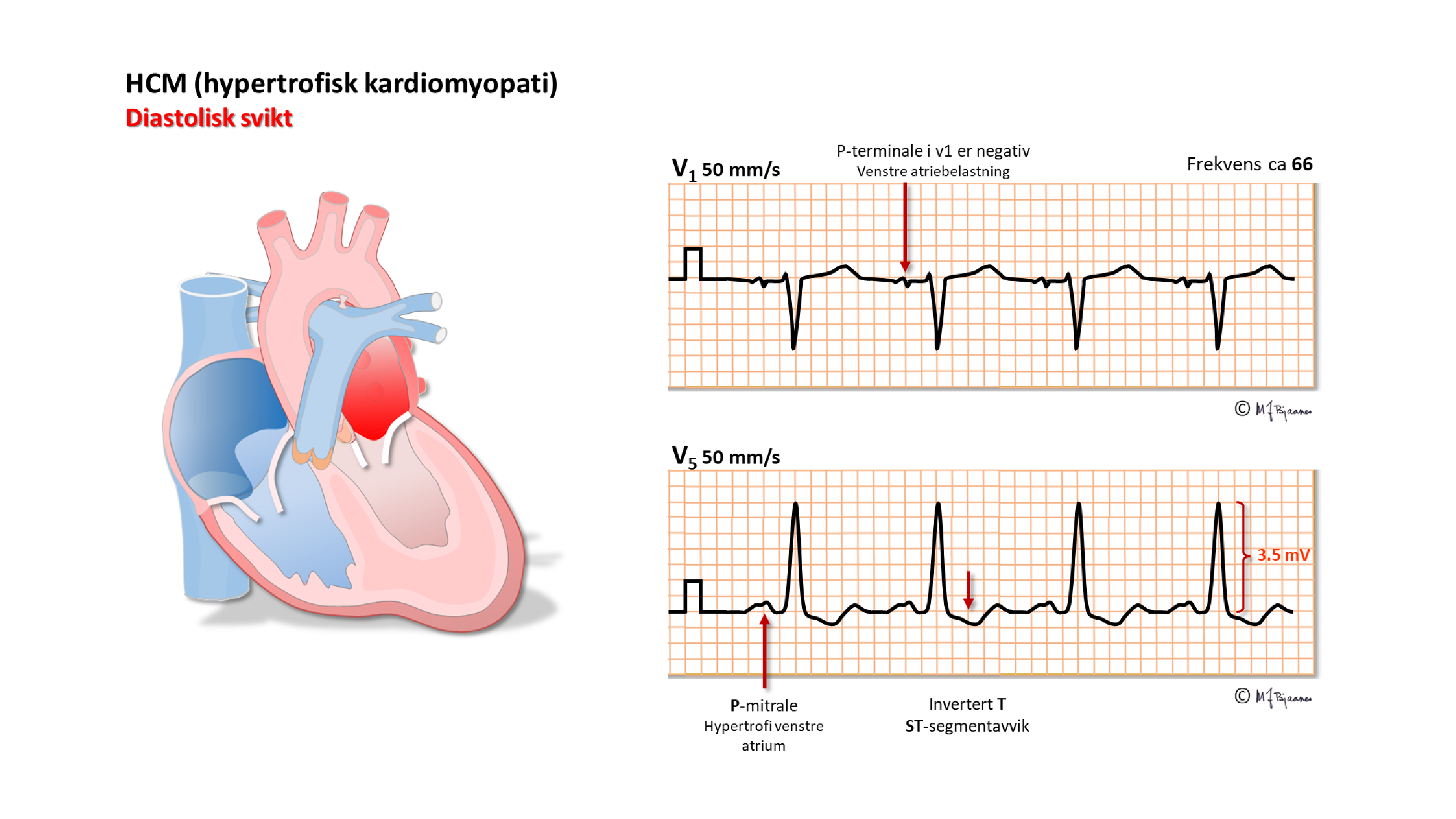
Ved fibrose blir hjertemuskelen stivere i diastolen, venstre atrium belastes, blir større og dreier bakover, og i V1 kan vi se en negativ P-terminale (40ms, 0,1 mV).
Den klassiske beskrivelsen av VVH i lærebøkene er Sokolow og Lyons, som baseres på at det blir økte elektriske krefter forover mot venstre, det vil si at S i V1 og R i V5-6 øker. Summen av utslagene ved standard forsterkning, 10 mm/mV skal normalt være < 35 mm, men nordmenn er ofte både kraftige og spreke, så < 37 mm grense brukes ofte hos oss. Menn har større utslag enn kvinner, yngre mer enn eldre, og veltrente mer enn utrente, så en må bruke skjønn heller enn absolutte grenser.

Hos mange fører hypertrofien til at apex dreies oppover mot venstre skulder, og de elektriske kreftene svinger opp til venstre og bakover. Legene ved Cornelluniversitetet i New York lagde sine alternative kriterier i form av summen av utslaget opp mot venstre (aVL) + utslaget bakover (vi bruker ikke ryggelektrode, så det ble S i V3). En Cornellsum på ≥ 20 mm hos kvinner og ≥ 28 mm hos menn tilsier sannsynlig VVH.
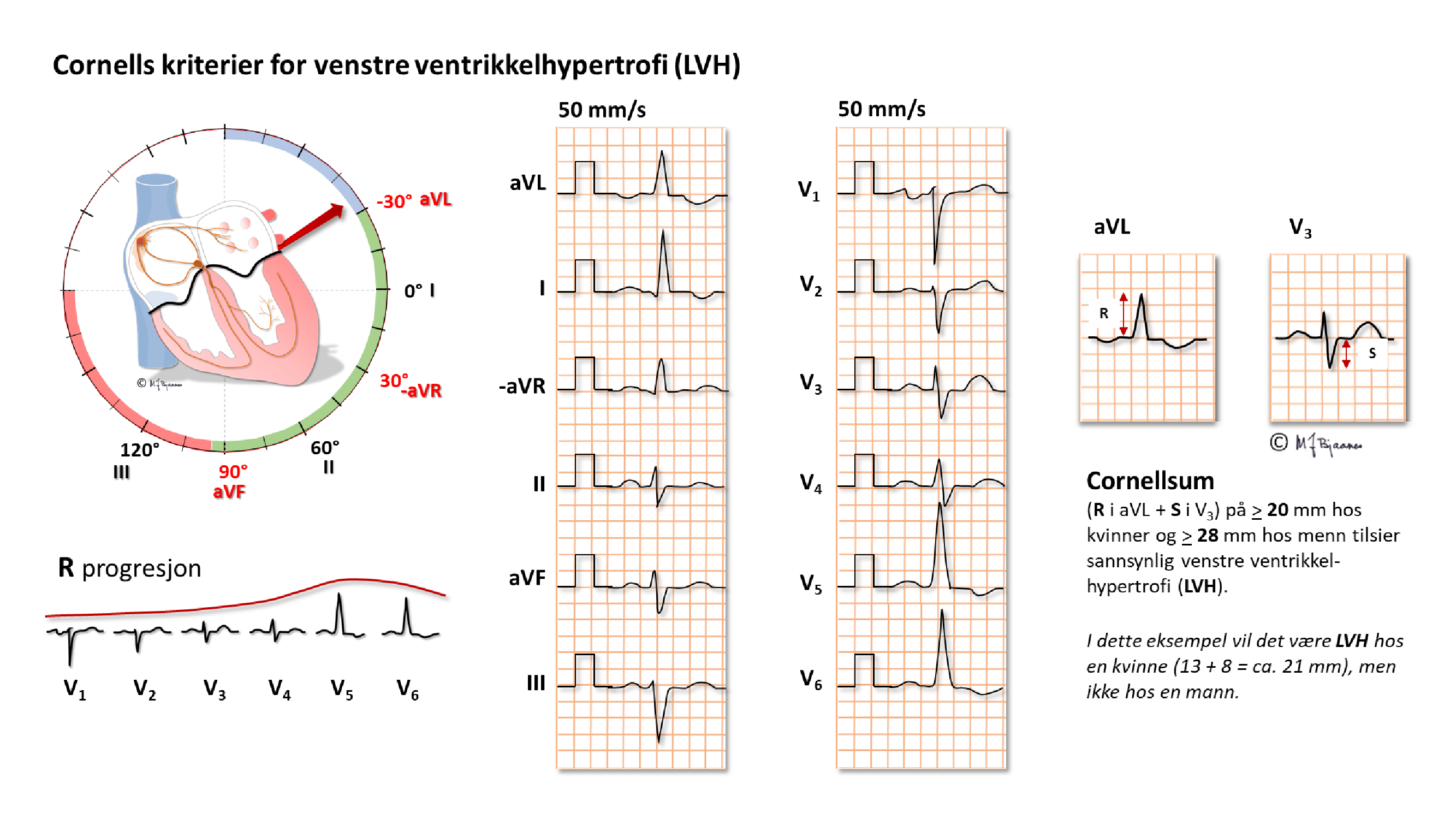
Cornellsummen oppdager en større andel av de med VVH enn det Sokolow-Lyon gjør, men metodene overlapper ikke mye, slik at det er lurt å vurdere begge.
Ved sykelig VVH det også bli langsommere impulsutbredelse. Det gir litt bredere QRS, som blir utnyttet i et volt-varighetsprodukt der Sokolow-Lyon- eller Cornellsummen multipliseres med QRS-varigheten i ms. Cornellproduktet er en del brukt i Norge: (R i aVL + S i V3 + tillegg av 6 mm for kvinner) x QRS varighet (ms). Et produkt > 2440 tilsier VVH.
er nok den EKG-formelen som fanger opp flest forandringer i EKG
| 3 poeng | I en standardavledning: en R eller S >2 mV (20 mm) Prekordial S i V1-2 eller R i V5-6 > 3 mV (30 mm) |
| 3 poeng | ST-T-aksene motstilt QRS |
| 3 poeng | Negativ P-terminale i V1 |
| 2 poeng | Venstre aksedeviasjon (mer venstre enn -30°) |
| 1 poeng | QRS-bredde ≥ 0,09 s |
| 1 poeng | Tid fra q til R-topp > 0,05 s |
| Maks poengsum 13, VVH ved ≥ 5 poeng. | |
Hos en veltrent vil hjertemuskelen bli tykkere, kamrene utvidet (særlig det tynne høyrekammeret), og den økte vagusstimuleringen gir langsom puls og store slagvolum. Men det skal ikke være økt fibrose, og derfor verken ST-T-bølgeavvik, venstre aksedeviasjon eller venstre atriebelastning.
Plutselig hjertedød forekommer noe hyppigere hos topptrente enn i befolkningen ellers, og skyldes arytmier, som oftest i hjerter med ionekanalsykdom (kanalopatier) eller strukturelle feil (kardiomyopatier) hos de unge, mens koronarsykdom er vanligste forklaring hos dem > 35 år.
Hypertrofisk kardiomyopati (HCM) er en viktig differensialdiagnose til idrettshjerte. HCM skyldes muterte/nedarvede genfeil som styrer muskelproteindannelsen, og gir en kraftig fortykket og stiv hjertemuskel, som regel med fibrose. Sykdommen disponerer for plutselig død. VVH mistenkt ut fra voltkriterier alene tilsier ikke videre utredning, men hvis det er annen patologi i EKG, en slektshistorie som gir mistanke, eller symptomer som brystsmerter, arytmifølelse eller uforklart besvimelse, skal en gå videre. Ekkoundersøkelse kan ofte avklare.
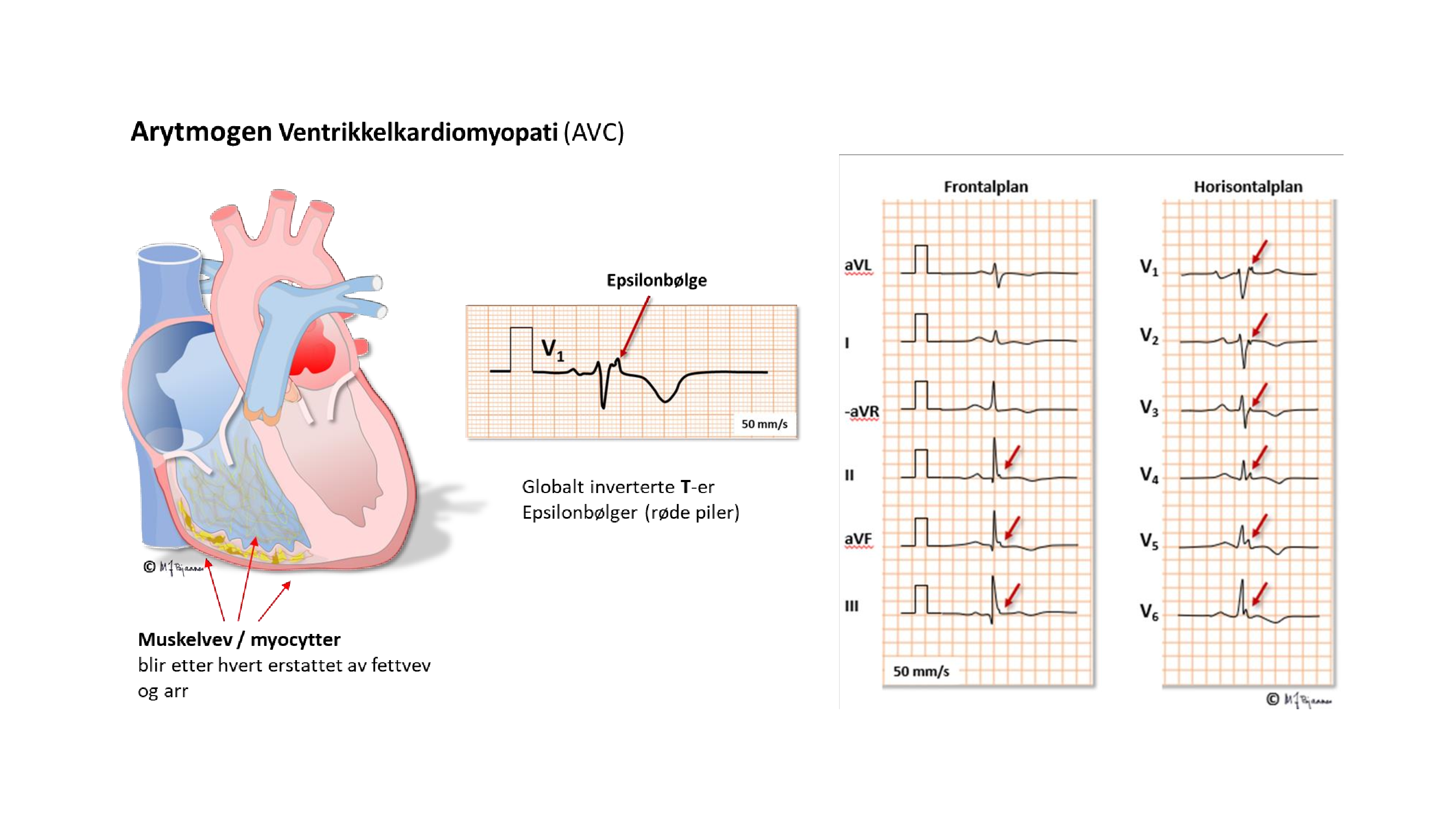
ARVC (Arrhythmogenic Right Ventricular Cardiomyopathy, nå omdøpt til AVC - Arrhythmogenic Ventricular Cardiomyopathy fordi også venstre ventrikkel kan rammes, er en annen viktig differensialdiagnose til treningshjerte. Denne sykdommen skyldes oftest mutasjoner i gener for proteiner i desmosomene, som danner limet mellom cellene. Sykdommen gir etter hvert omdannelse av myokardvev til bindevev og fettceller i både høyre og venstre ventrikkel). Pasientene har økt risiko for plutselig død i ung alder, og noen utvikler hjertesvikt. Langvarig hard trening synes å fremskynde sykdomsutviklingen. Diagnosen stilles ut fra et sett kriterier som omfatter familiehistorikk, genetiske analyser, EKG-forandringer, ekkokardiografi og MR. Forandringene rammer høyre ventrikkel mest, og de karakteristiske EKG-forandringene er fragmentert signal i bakkant av QRS (såkalt epsilonbølge) og T-inversjoner i forveggen (V3 og ev. utover hos menn, V4 og ut hos kvinner).
Dilatert kardiomyopati kan komme etter barsel, etter infeksjoner, kan skyldes arv, men kan også ha ukjent årsak (være idiopatisk). I EKG kan en se mange slags forandringer: venstre atriebelastning (terminalt negativ P i V1), AV-blokk, QRS breddeøkning, akseendring eller grenblokk, ST-avvik og T-inversjoner. Ofte er QRS-amplitudene små fordi blodet i de dilaterte hjertekamrene er dårlig strømleder.
Iskemisk kardiomyopati skyldes som regel gjennomgåtte infarkter, og EKG forandres i henhold til skadeseder og omfang.
Hypotermi
Man kan se bradykardier, breddeøkte komplekser og intervaller, markerte
J-bølger og muskelstøy fra skjelving. Det kan bli ekstrasystoler,
ventrikkeltakykardi, ventrikkelflimmer eller asystole.
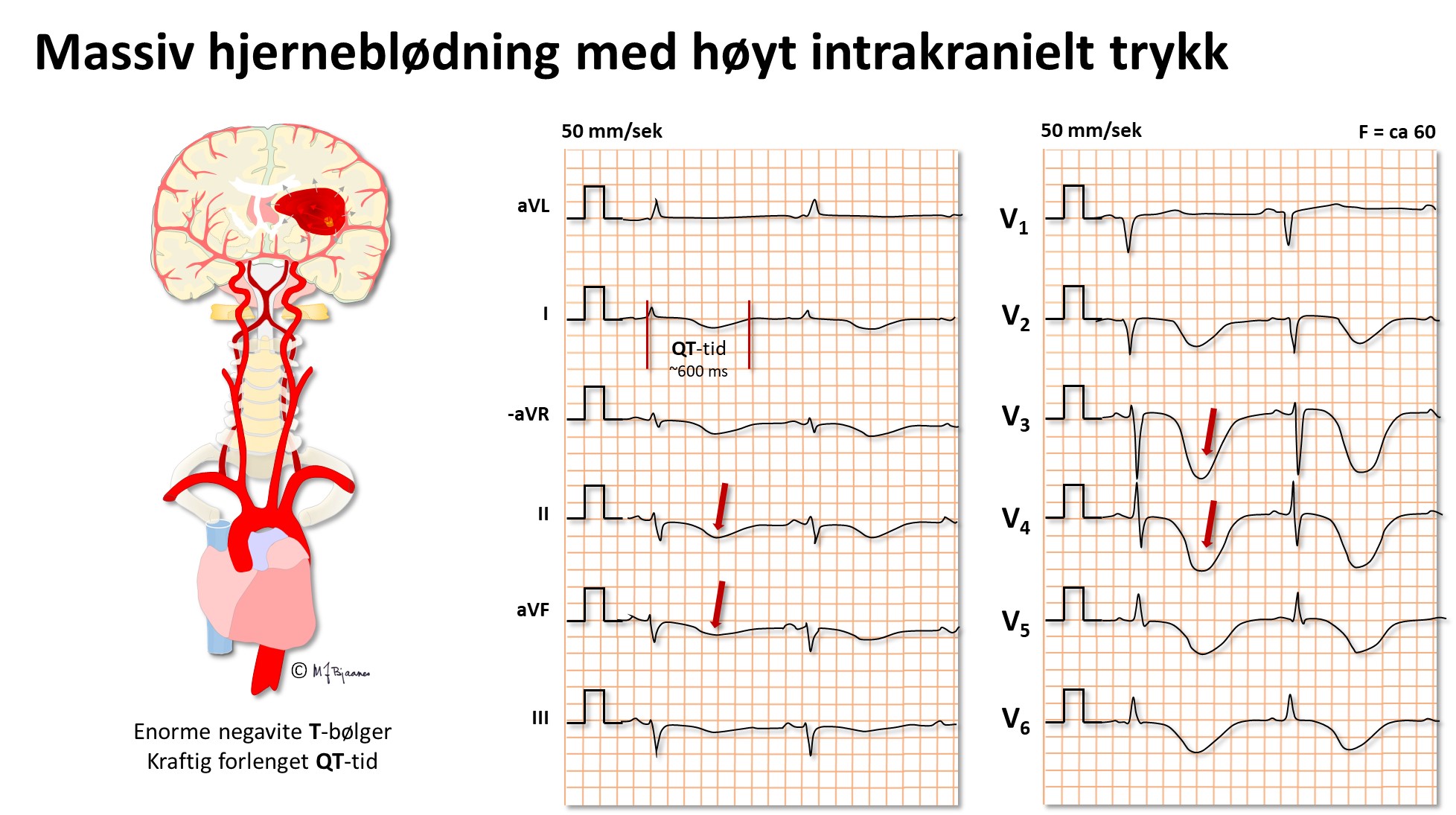
Hjerneblødning og høyt intrakranielt trykk
Kan forandre EKG. Dype brede T-bølger er karakteristisk, likeså bradykardi.
Intoksikasjoner
Man kan se brady- og takyarytmier, breddeøkte QRS, ST-avvik, påvirket
QT-tid og T-bølgeforandringer, beroende på hva slags agens som er
inntatt.
Parkinsons sykdom
Skjelvingene kan gi muskelstøy, mer i standardavledningene enn i prekordialene ettersom ekstremitetene rammes mest.
Strømskade
Fører i blant til arytmier.
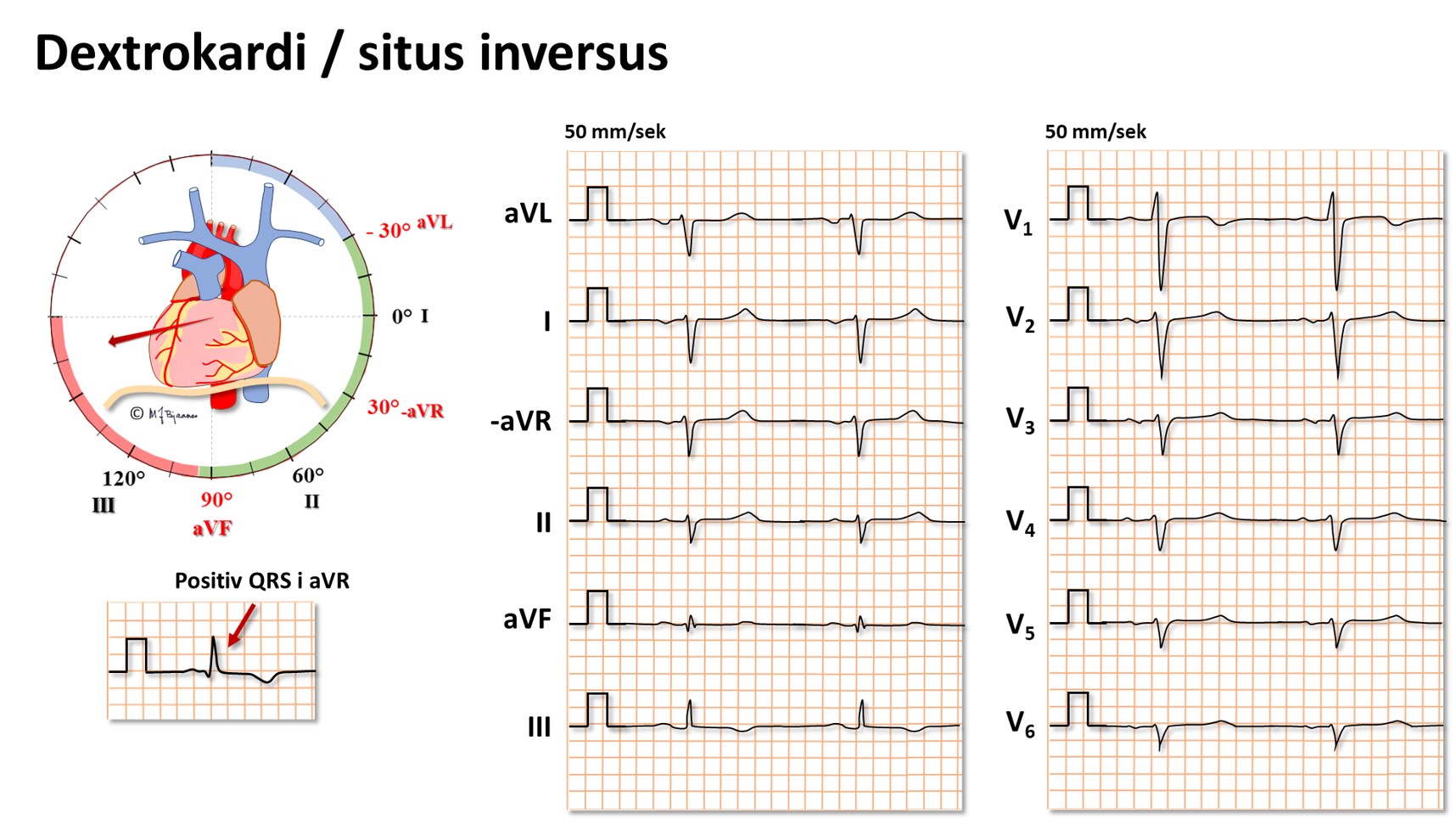
Dextrokardi og situs inversus
Hos 1 av 12000 er hjertet plassert speilvendt i toraks (dextrokardi),
ofte som ledd i total situs inversus hvor alle organer er speilvendt.
Da blir naturligvis EKG annerledes, men det blir normalt hvis alle
elektrodene plasseres speilvendt. EKG nedenfor viser: ekstrem høyre akse
deviasjon, positiv QRS i aVR, negativ R-progresjon i V1 - V6, små utslag
i V3-V6 og gjennomgående negative P og QRS i frontalplanets
avledninger.
Misdannelser i hjerte-kar
De som er vokst opp med medfødte misdannelser i hjertet (GUCH, grown up congenital hearts), kan ha alle slags anomalier i EKG.
Hjertetransplanterte
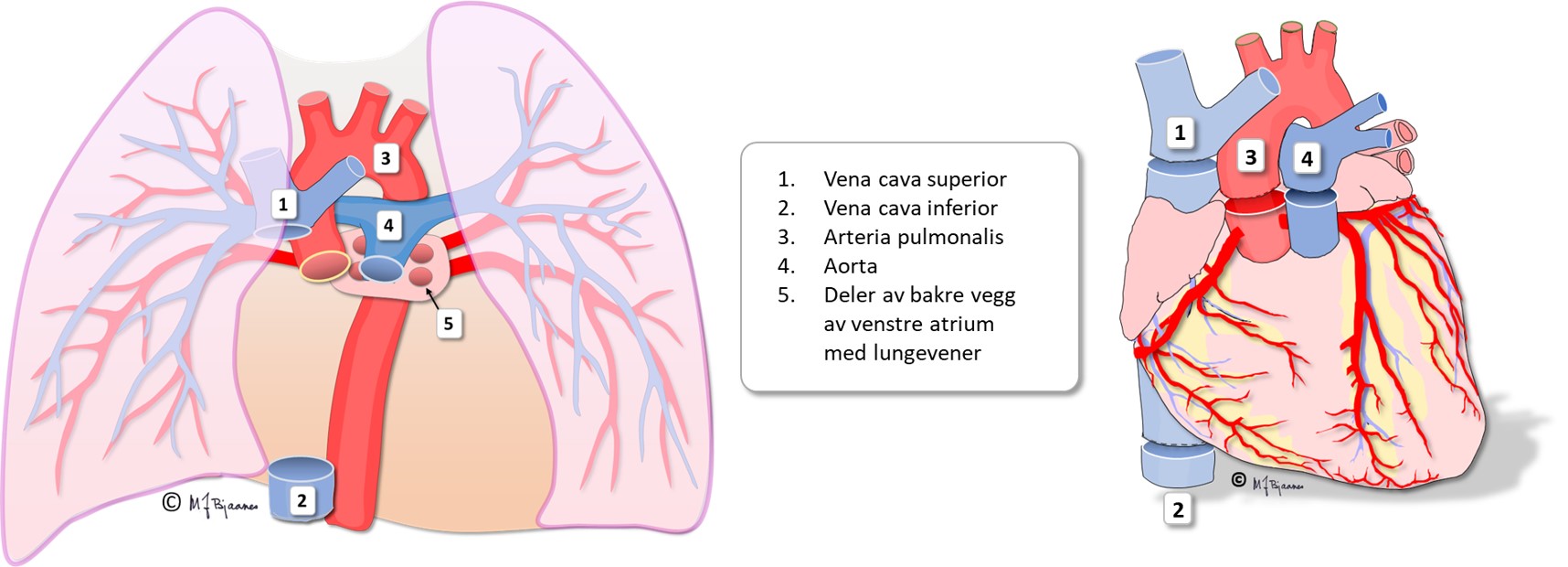
Det gamle hjertet fjernes under operasjonen, så bare baksiden av venstre
atrium blir igjen som feste for det nye hjertet. De store karene kobles
til de tilsvarende i det nye hjertet: hulvener, lungearterie, og aorta.
Den nye sinusknuten gir en hvilepuls på rundt 100/min fordi den er
denervert. Vi vet ikke helt hva det skyldes, men det er vanlig med litt
bredere QRS med rSr’ i V1 (inkomplett høyre grenblokk) eller ev. fullt høyre grenblokk hos transplanterte. Denerveringen gjør også at det nye hjertet mangler smertesans, så EKG blir viktig i oppfølgingen.
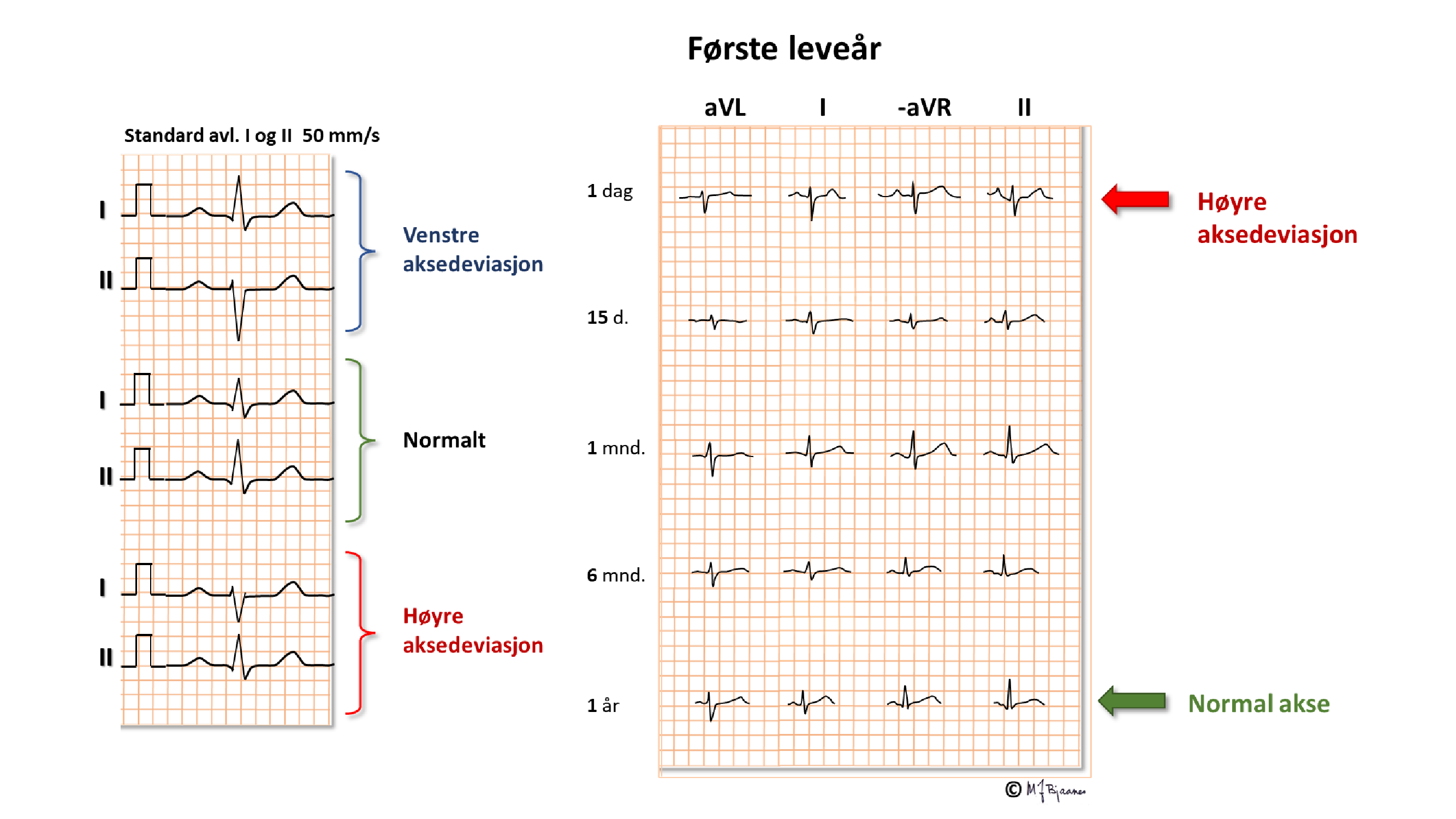
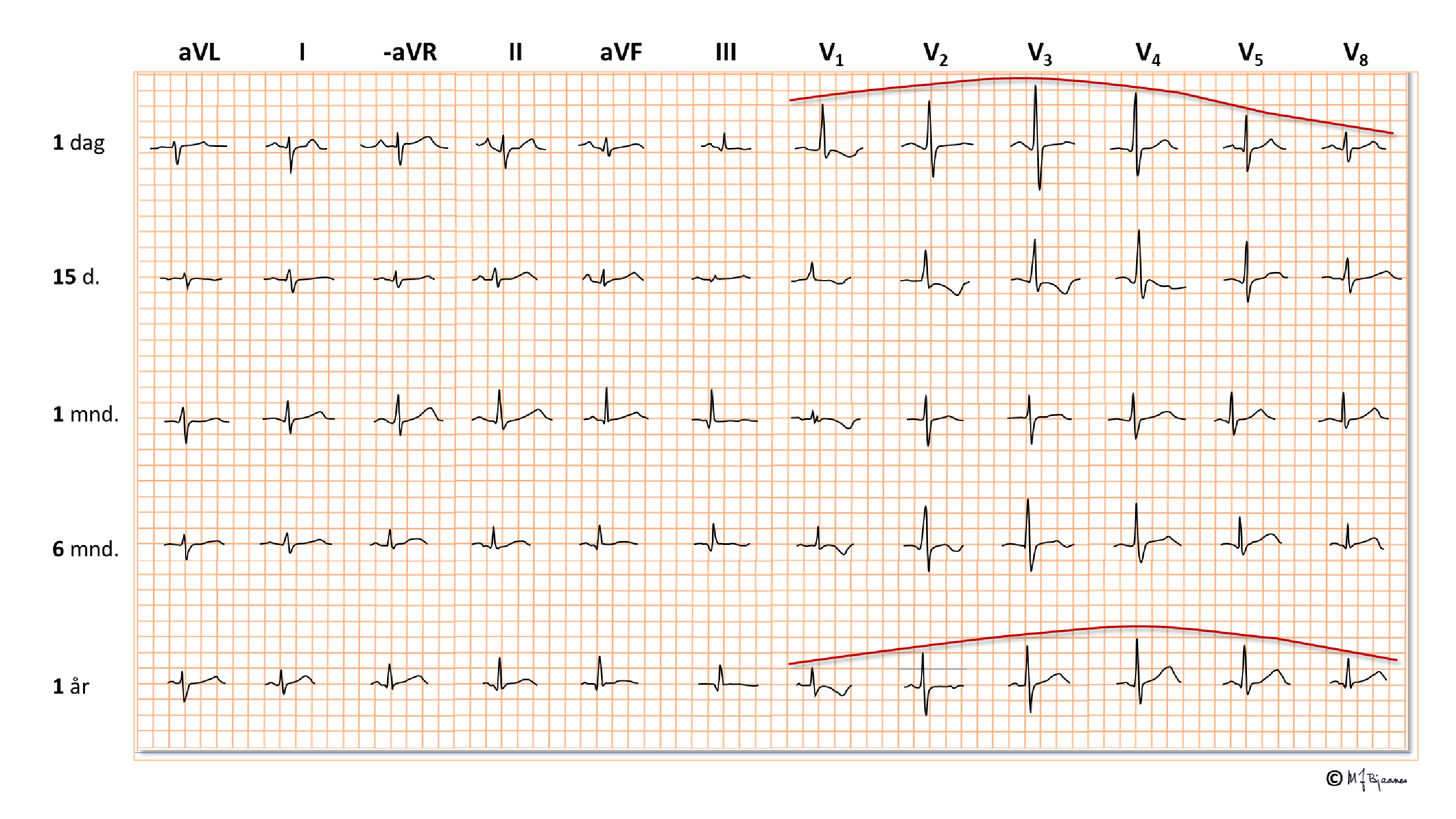
Dette er en kortfattet beskrivelse av de viktigste prinsippene for taking og tyding av normale EKG hos barn. Ved mistanke om patologiske funn bør barnelege rådspørres. I fosterlivet kommer oksygenert blod fra morkaken gjennom navlesnoren til nedre hulvene, og derfra videre til høyre atrium. Mesteparten av dette blodet går gjennom foramen ovale til venstre atrium, venstre ventrikkel og videre ut i aorta. En liten del (< 10%) pumpes fra høyre ventrikkel til lungearteriene. Lite går til lungene, som har høy motstand ettersom de ikke er utfoldet, og resten, med lav oksygenmetning, passerer via ductus arteriosus (Botalli) over til aorta.
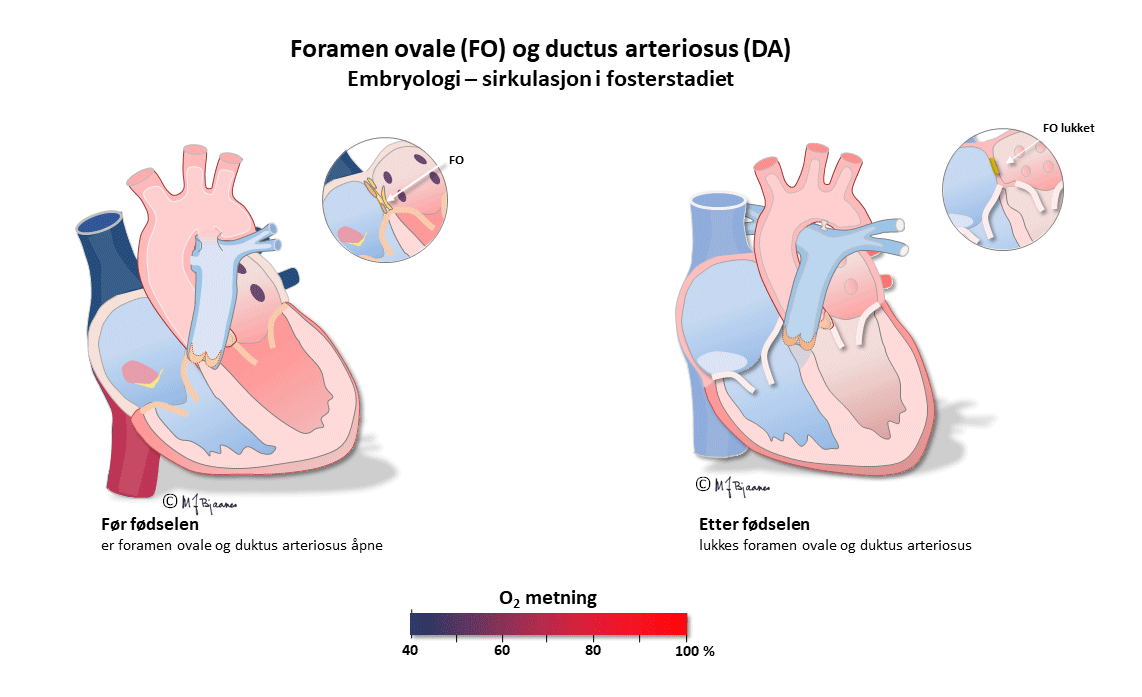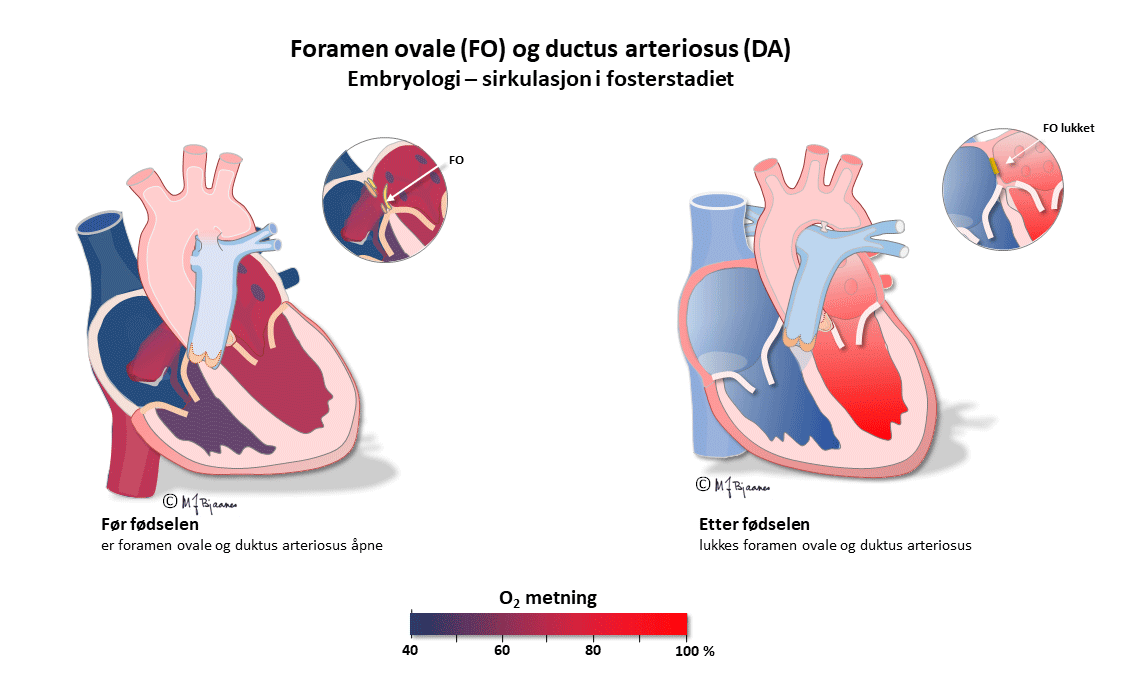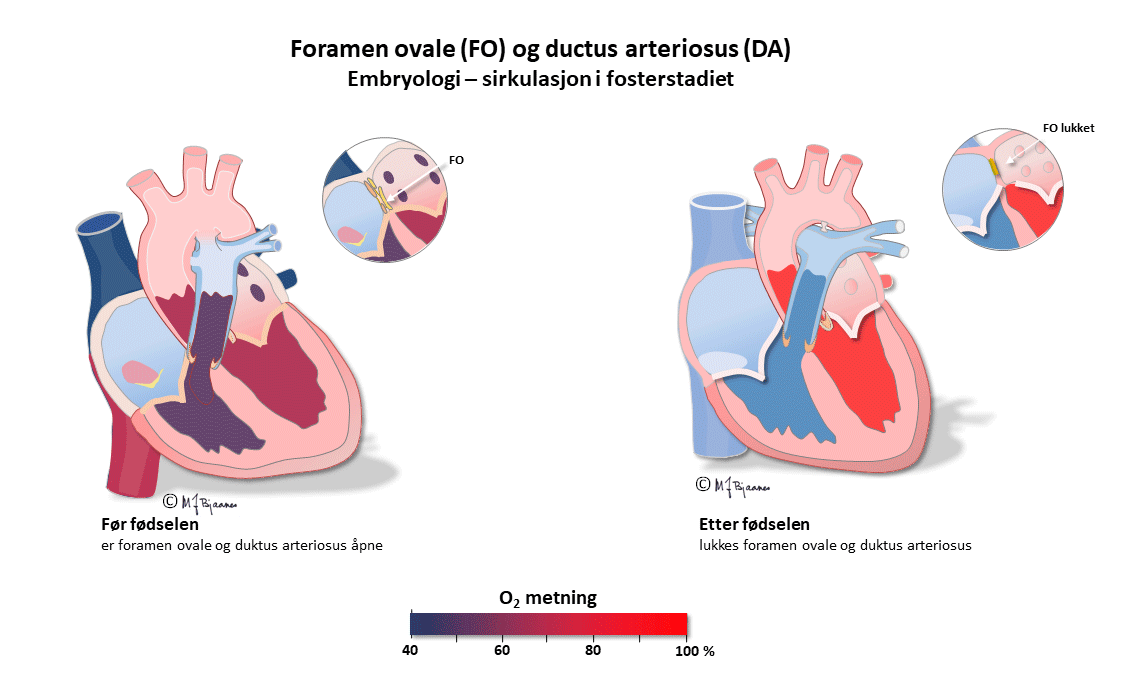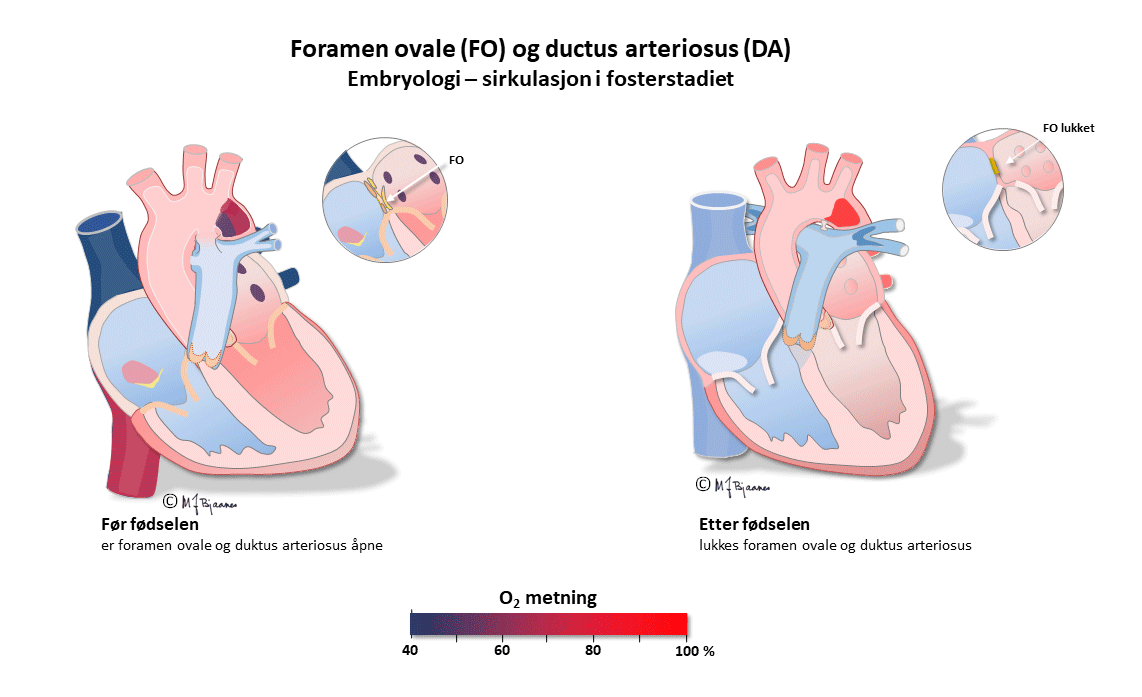
Det betyr at det største pumpearbeidet i fosterlivet utføres av høyre hjertehalvdel. Etter fødselen foldes lungene ut, ductus arteriosus lukkes, og trykket i v.atrium, som nå er blitt høyere enn i det venstre, presser seilet over foramen ovale inn så det lukker åpningen. Nå arbeider venstre hjertekammer mot systemtrykket og får den største belastningen, mens høyre hjertehalvdel står for det lave trykket i det lille kretsløpet.

Pediatere «ofrer» derfor ofte prekordialavledningen V4 til fordel for en høyresidig V4 (V4R) hos spedbarn og småbarn:
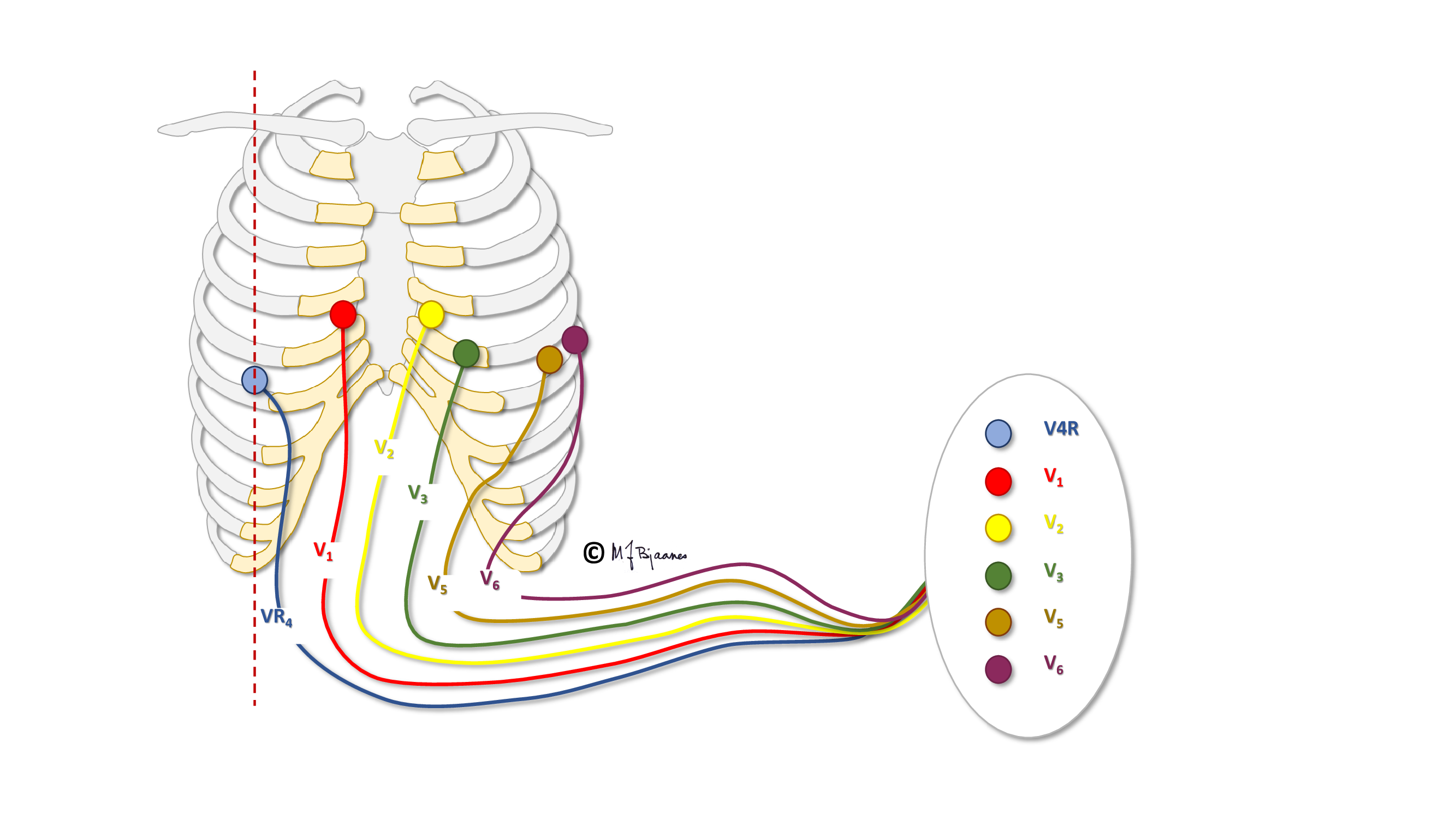
Under oppveksten
Hos mange skjer denne remodelleringen tidlig, men hos noe persisterer et juvenilt mønster opp mot voksen alder. Hver alder har sine normalmål, med vide konfidensrammer og noen forskjeller mellom kjønnene. Det fins flere referansetabeller (bl.a. P. R. Rijnbeek og medarb. New normal limits for the paediatric electrocardiogram. European Heart Journal 2001;22:702–11, https://doi.org/10.1053/euhj.2000.2399).
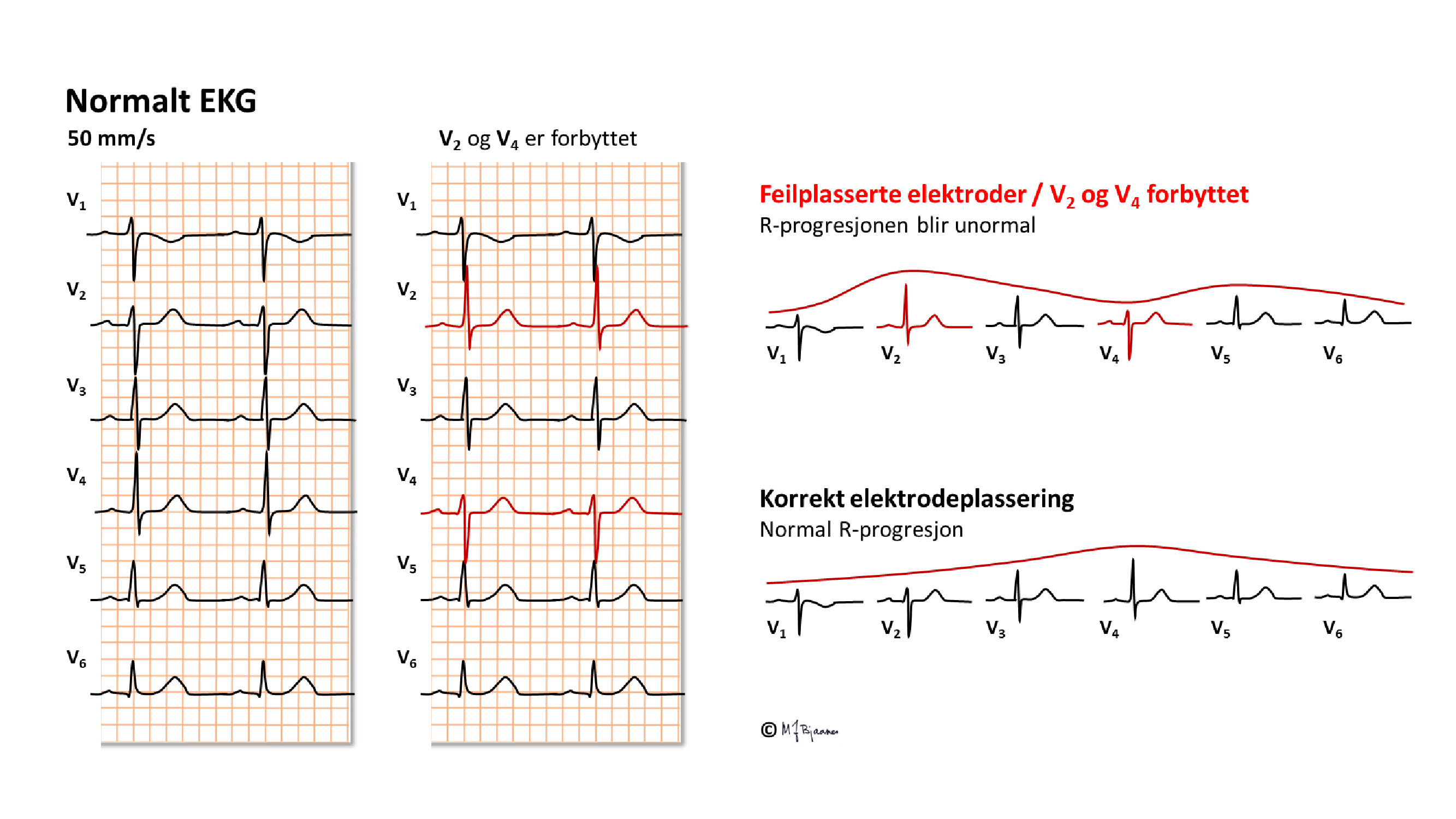
Forbyttede eller feilplasserte elektroder
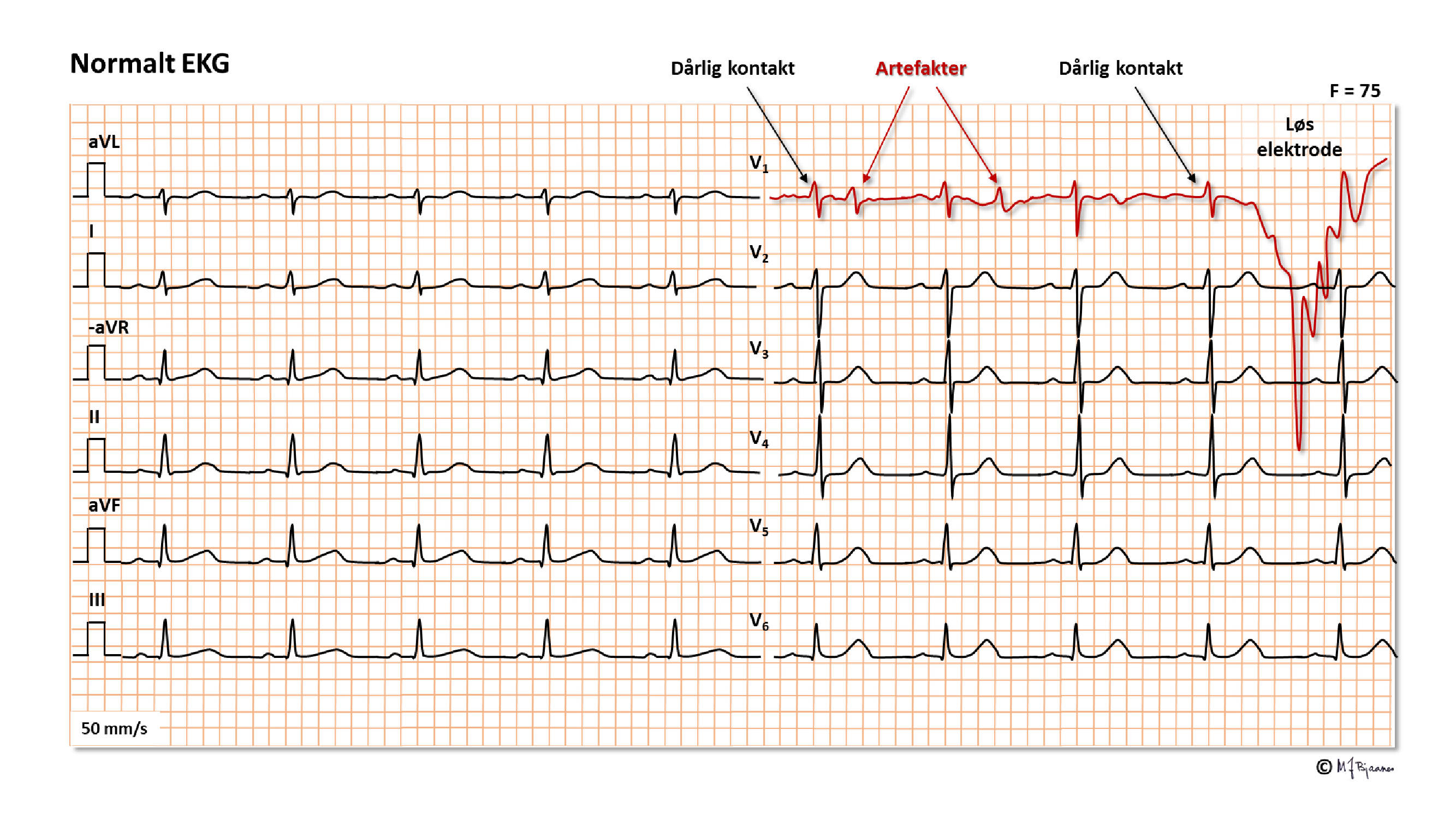
Det er lurt å ha en fast rutine når en setter på elektrodene og kobler dem til kablene. En vanlig feil er at prekordialene plasseres ett interkostalrom for høyt. Da vil v1 likne på aVR og gi mistanke om et gjennomgått anteroseptalt infarkt. Hvis v6 ikke er plassert helt ut til midtaksillen, kan man undervurdere høyden på apex-R.
HA, VA og VB følger trafikklysets farger (rødt, gult, grønt), og det samme gjør v1-v3. Det er lett å forveksle de som har samme farge selv om de er merket forskjellig. Hvis EKG ser rart ut, bør en sjekke elektroder og koblinger.
Feil filtersetting
gjelder særlig muskelstøyfilteret (30-40 hertz), som er nyttig ved
arbeidstest, skopovervåking og langtidsregistrering, men som ikke skal
brukes ved hvile-EKG fordi QRS ved filterbruk får slakkere start og
avslutning, blir bredere, og klippes ned i snitt rundt 20%. Det
ødelegger især for hypertrofidiagnostikken, men også oppsplitting av QRS
(fragmentering) ved myokardfibrose kan forsvinne.