
Grunnlaget for elektriske impulser er et overskudd av negativt ladede partikler/ioner inne i hjertecellene og et overskudd av positivt ladede partikler/ioner på utsiden. Dette er situasjonen når hjertet er i hvilefase.

Det "negative overskuddet" inne i cellene lages dels av negativt ladede proteiner og dels av at det bare er de positivt ladede ionene (K+) som kan forlate cellene i hvilefasen. Det er mye større konsentrasjon av K+ inne i cellene (ca. 150 mM) sammenlignet med utsiden (ca. 4 mM). K+ har derfor en tendens til å forlate cellene ved diffusjon, og etterlate seg et enda større overskudd av negative ladninger inne i cellene.
Ladningsforskjellen mellom innsiden (negativ) og utsiden (positiv) av cellemembranen skaper potensiell energi, dvs. et elektrisk potensial som kan måles som en spenningsforskjell. Spenningsforskjellen mellom innsiden og utsiden av cellen i hvile kalles hvilemembranpotensialet, og er ca. minus 90 mV i ventrikkelceller. I denne fasen kan man si at membranen er polarisert.
Hvilemembranpotensialet avhenger av to viktige bestanddeler i cellene:
OBS! Animasjonen har verbal forklaring. Skru på lyd.
Kalsium
Cellemembranen inneholder også andre ionekanaler som reagerer på spenningsendringer, bl.a. kalsiumkanaler. Kalsiumkanalene åpner etter at natriumkanalene har åpnet seg og medført et spenningsfall over cellemembranen. Siden det er mye større konsentrasjon av Ca2+ på utsiden (ca. 2 mM) enn på innsiden (ca. 0,0001 mM), vil kalsium strømme inn i cellene når kalsiumkanalene åpnes.
Inne i cellene er det er stort lager (sarkoplasmatisk retikulum) med høy konsentrasjon av kalsium. Ca2+, som strømmer inn i cellene fra utsiden, binder seg til en lukket kanal i dette lageret (ryanodinreseptoren, RyR), som dermed åpnes og slipper store mengder Ca2+ ut i cytosol.
Ca2+ i cytosol binder seg til troponin C i komplekset av kontraktile proteiner og innleder glidebevegelsen mellom aktin og myosin, som fører til sammentrekning i sarkomerene.
Kalium
Åpning av natrium- og kalsiumkanaler i cellemembranen fører altså til at positivt ladede partikler strømmer inn i cellene, og cellemembranen depolariseres. Kanalene står imidlertid kun åpne en kort stund. Dessuten medfører depolariseringen at nye kaliumkanaler åpner. Dermed kan K+ strømme ut av cellene. Dette har en motsatt effekt av natrium- og kalsiumkanalene. Vi sier at K+ som strømmer ut av cellene, har en repolariserende effekt på cellemembranen. Ved repolariseringen lukkes natriumkanalene.
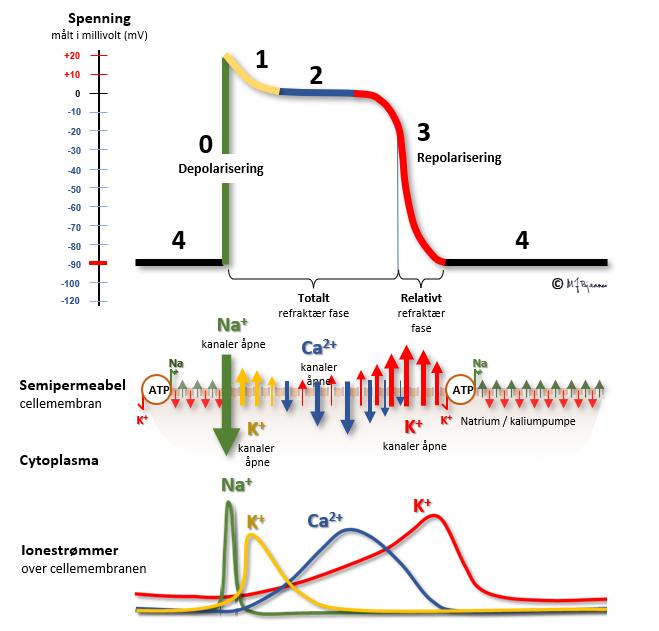
Bevegelsene av ioner over cellemembranen følger et fast mønster i hvert hjerteslag. Dette mønsteret medfører en variasjon i potensialet som kan måles over cellemembranen, og kalles aksjonspotensialet. Aksjonspotensialet i en celle avhenger av mengde og aktivitet i de forskjellige ionekanalene i cellemembranen. Beskrivelsen vi har gitt hittil, gjelder for majoriteten av atrie- og ventrikkelceller:
I utgangspunktet er cellemembranen polarisert. Na+-innstrømming i cellene medfører depolarisering (fase 0). Dette leder til åpning av kalsiumkanaler, men også til åpning av flere typer kaliumkanaler. Én kaliumkanaltype åpner tidlig, og gir en delvis, tidlig repolarisering (fase 1), fra ca. +30 mV til 0 mV. Denne tendensen til repolarisering balanseres imidlertid av at Ca2+ strømmer inn i cellene og depolariserer. Dermed blir membranpotensialet stabilt i en periode, aksjonspotensialets platåfase (fase 2). Med noe forsinkelse åpner så flere kaliumkanaler, mens kalsiumkanalene lukker. Da dominerer utstrømmingen av K+, med repolarisering av cellemembranen til følge (fase 3). Til slutt når cellemembranen sin hviletilstand når Na+/K+-pumpen sørger for at Na+ pumpes ut av cellen igjen i bytte mot K+, som pumpes inn i cellen (fase 4).
Figuren viser hvordan aksjonspotensialet ser ut i en myocytt i ventriklene eller atriene. Pacemakercellene har et helt annet mønster, se figuren nedenfor:
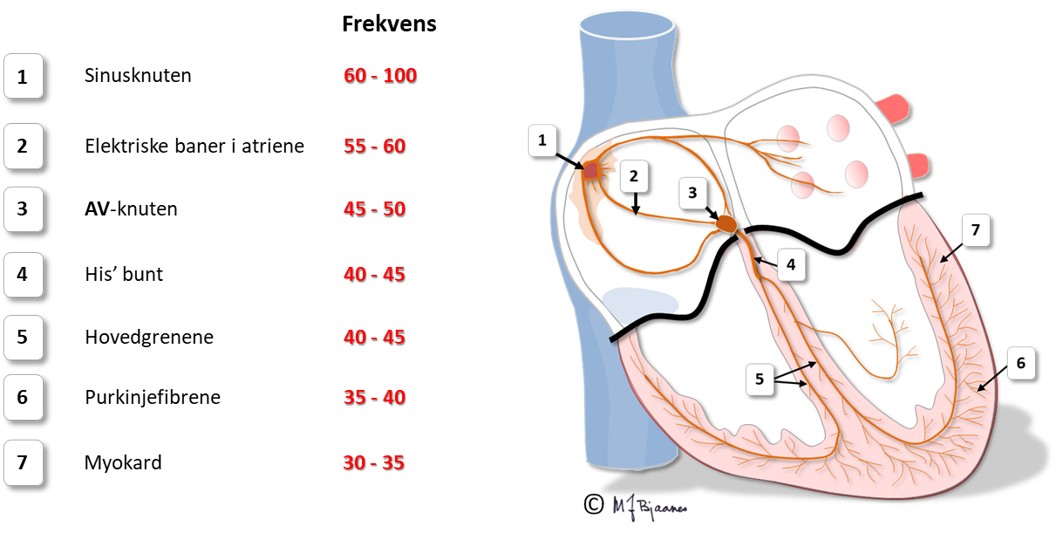
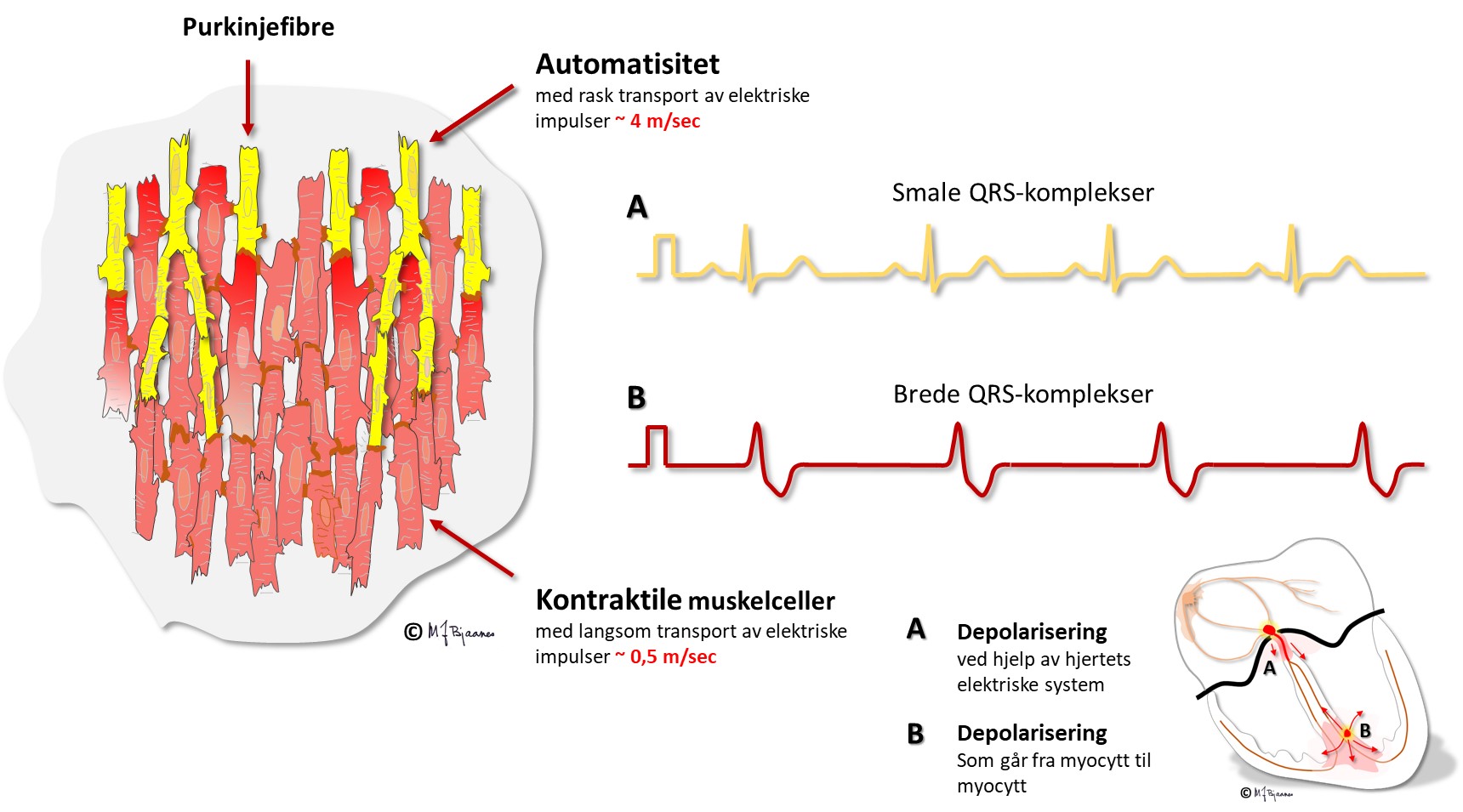
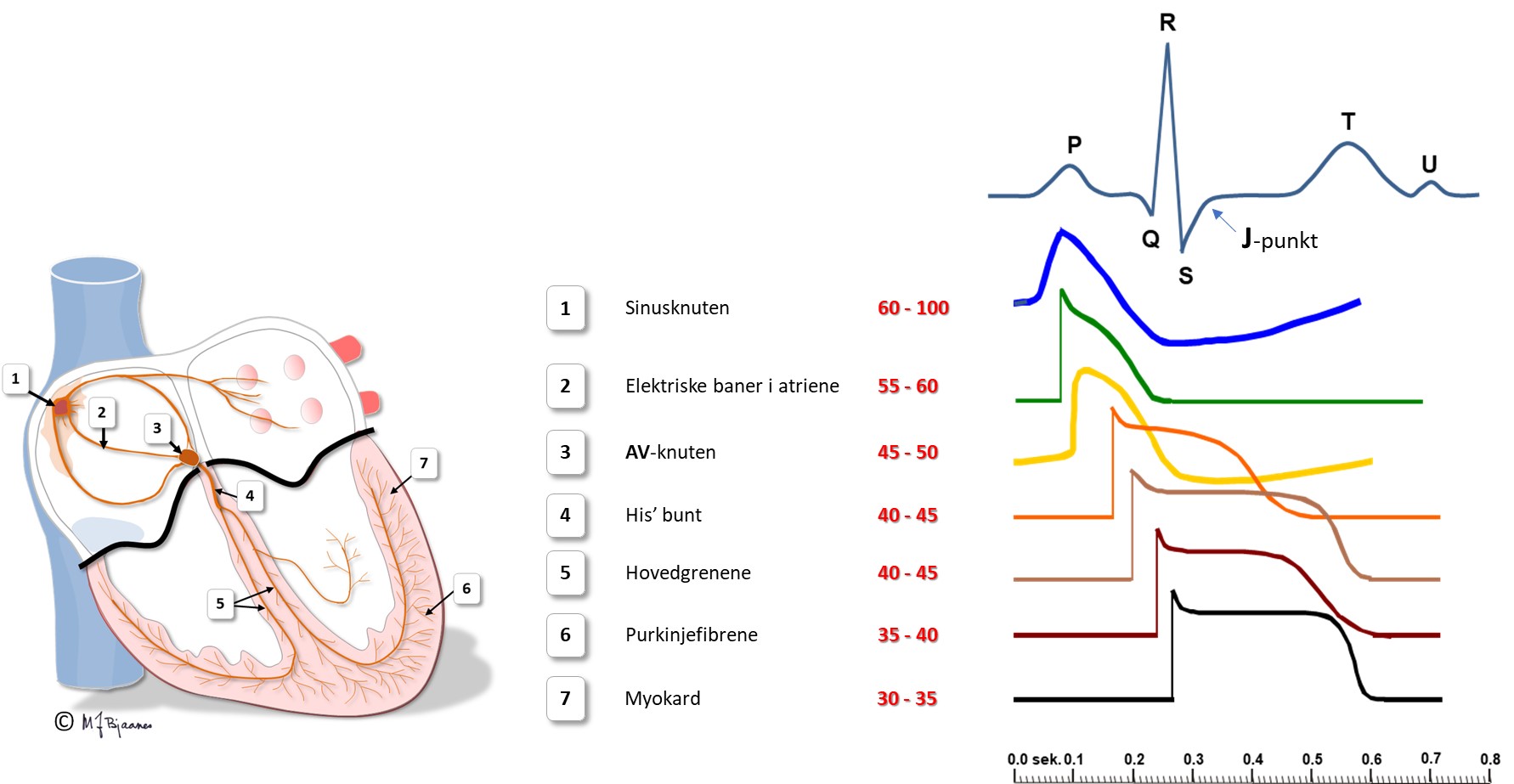
Ledningscellene i His’ bunt, ledningsgrenene til henholdsvis høyre og venstre ventrikler, fasiklene og purkinjefibrene er tykkere, langstrakte og har kabelfunksjon. Deres utseende vitner om at hovedfunksjonen ikke er kontraksjon. Også de har pacemakerfunksjon, men fyrer mye langsommere enn cellene i sinus- og AV-knuten.
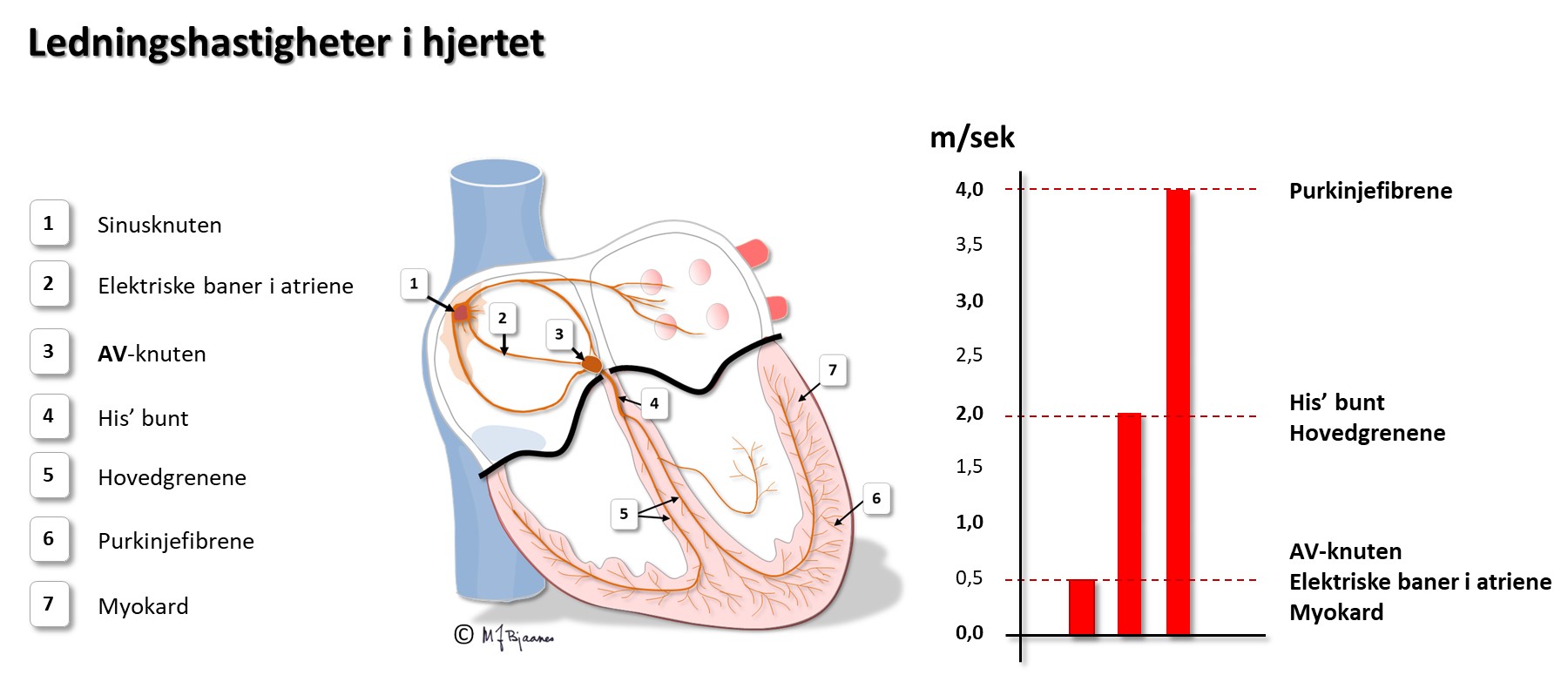
Celletypene i hjertet og deres organisering gjør at impulsene spres på en måte som gjør hjertets arbeid effektivt og energiøkonomisk. Depolariseringen spres raskt til hele cellen, men forsinkes i innskuddsskivene. (Dette blir beskrevet mer i detalj i avsnittet om kardiomyocyttene). I vevet går derfor impulsene mye raskere i muskulatur der fibrene er orientert på langs enn på tvers. Aller raskest går det i de spesialiserte langstrakte ledningscellene.
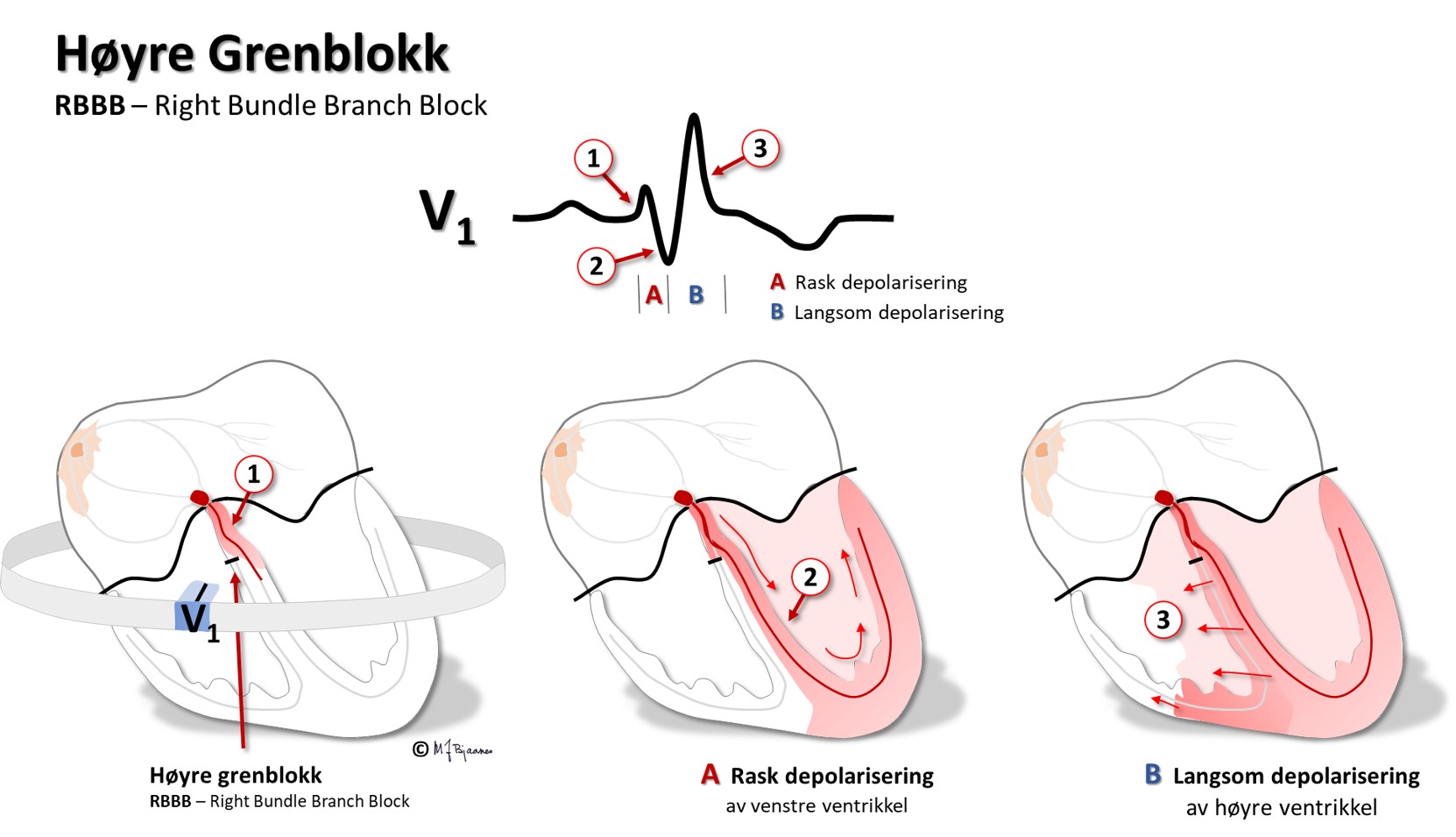
I EKG vises depolariseringen som QRS-takker. De blir smale når
hjertekamrene aktiveres raskt gjennom ledningssystemet, men brede hvis
impulsene spres fra myocytt til myocytt utenom ledningssystemet.
Ledningshastigheten i de enkelte delene av hjertet vises under.
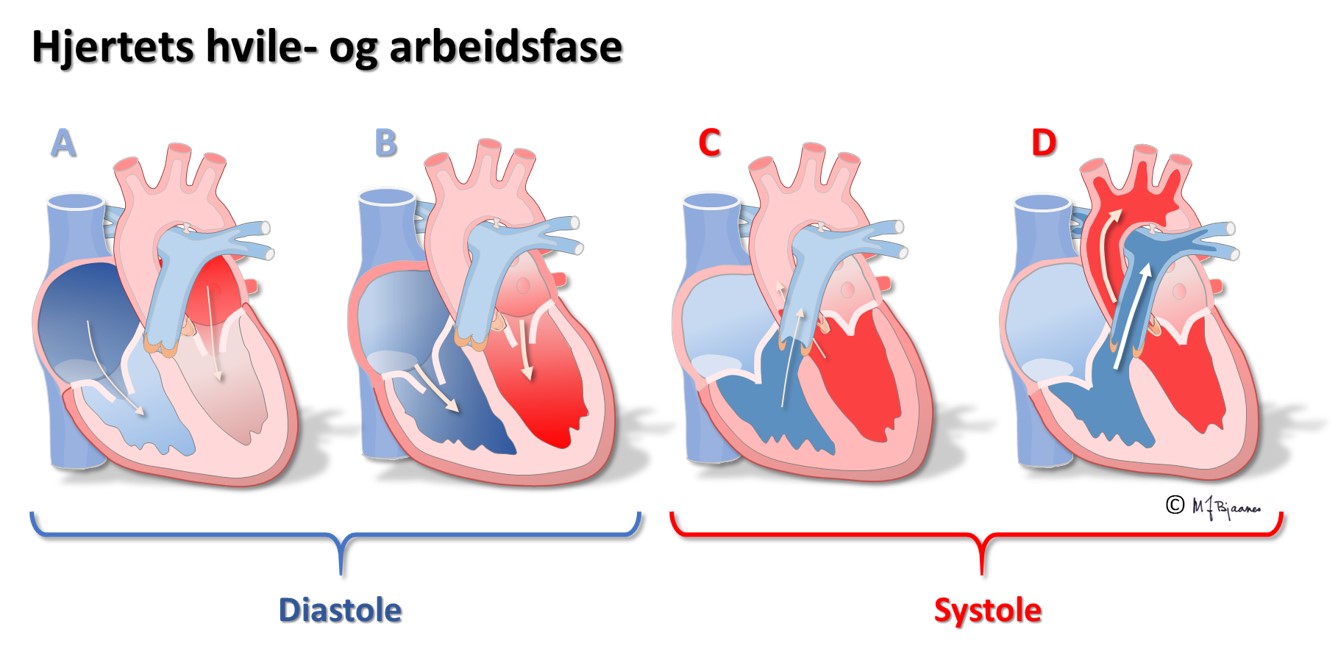
Tømmingen av forkamrene lettes ved at kontraksjonen starter høyt og brer seg ned mot innløpsklaffene. AV-knuten stanser impulser som kommer for tett på hverandre. Det gir sikkerhet hvis en feil i forkamrene (for eksempel atrieflimmer) skulle gjøre at AV-knuten pepres med farlig korte mellomrom. Også de normale impulsene forsinkes slik at fyllingen av hjertekamrene får nok tid. Når atriene kontraherer, får vi en ekstra påfylling av ventriklene, og det økte veggstrekket ("preload") gir økt pumpekraft i ventriklene. Timingen av atrienes og ventriklenes kontraksjon har derfor betydning for hjertepumpens effektivitet.
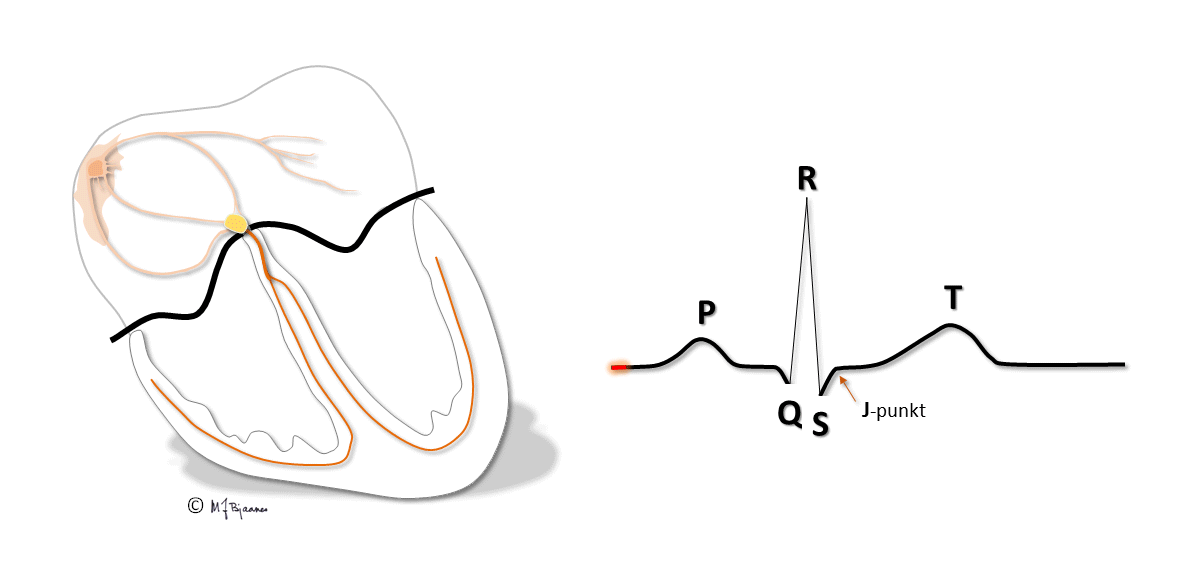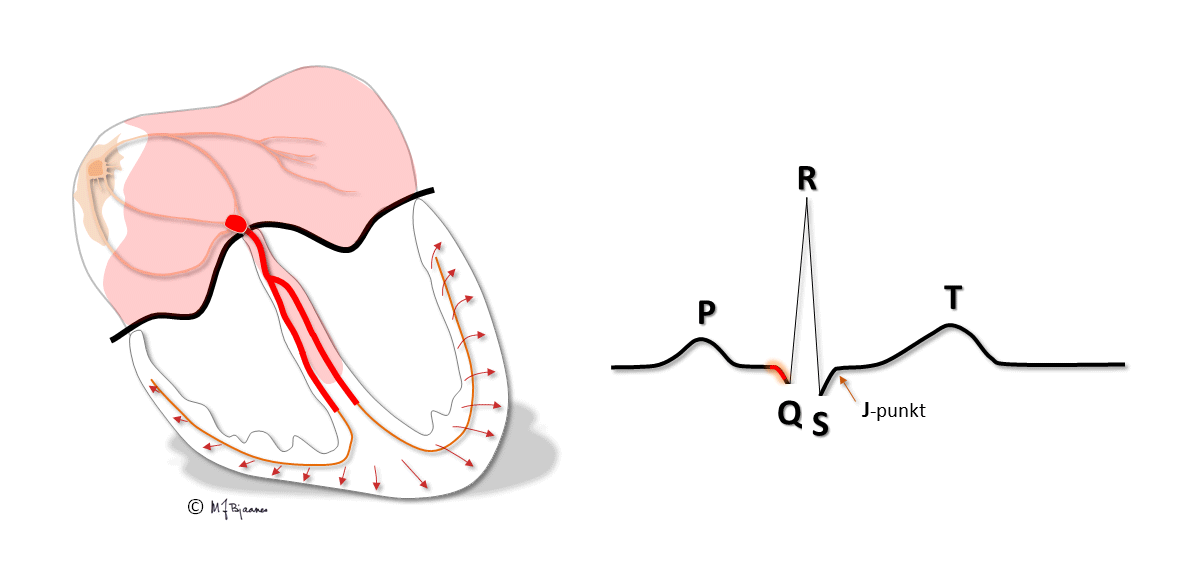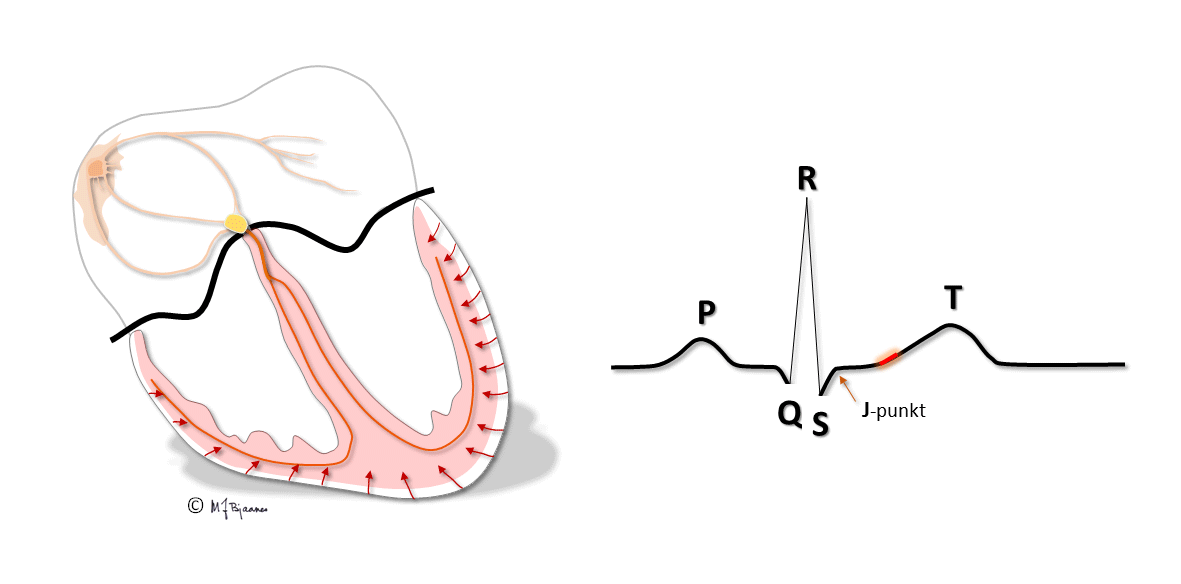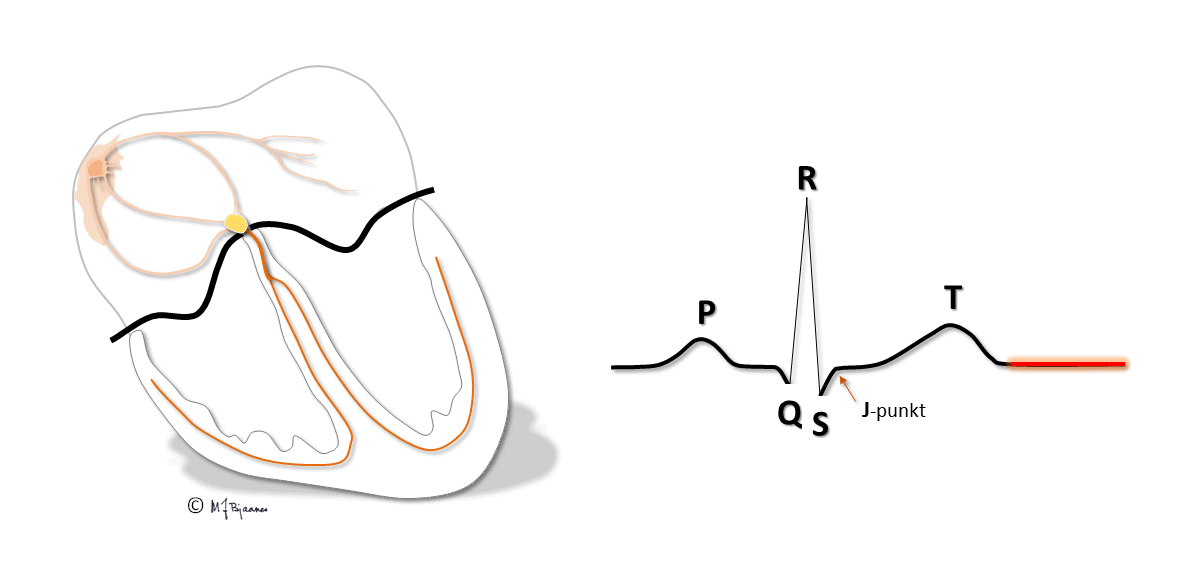
Den første aktiveringen i hjertekamrene skjer høyt i septum, som derved strammes opp og stabiliseres. Impulser som følger ledningssystemet, spres raskt i begge hjertekamrene og aktiverer all muskulatur nesten samtidig. Det gir en samlet kontraksjon av ventriklene, så blodet pumpes effektivt ut av hjertet.
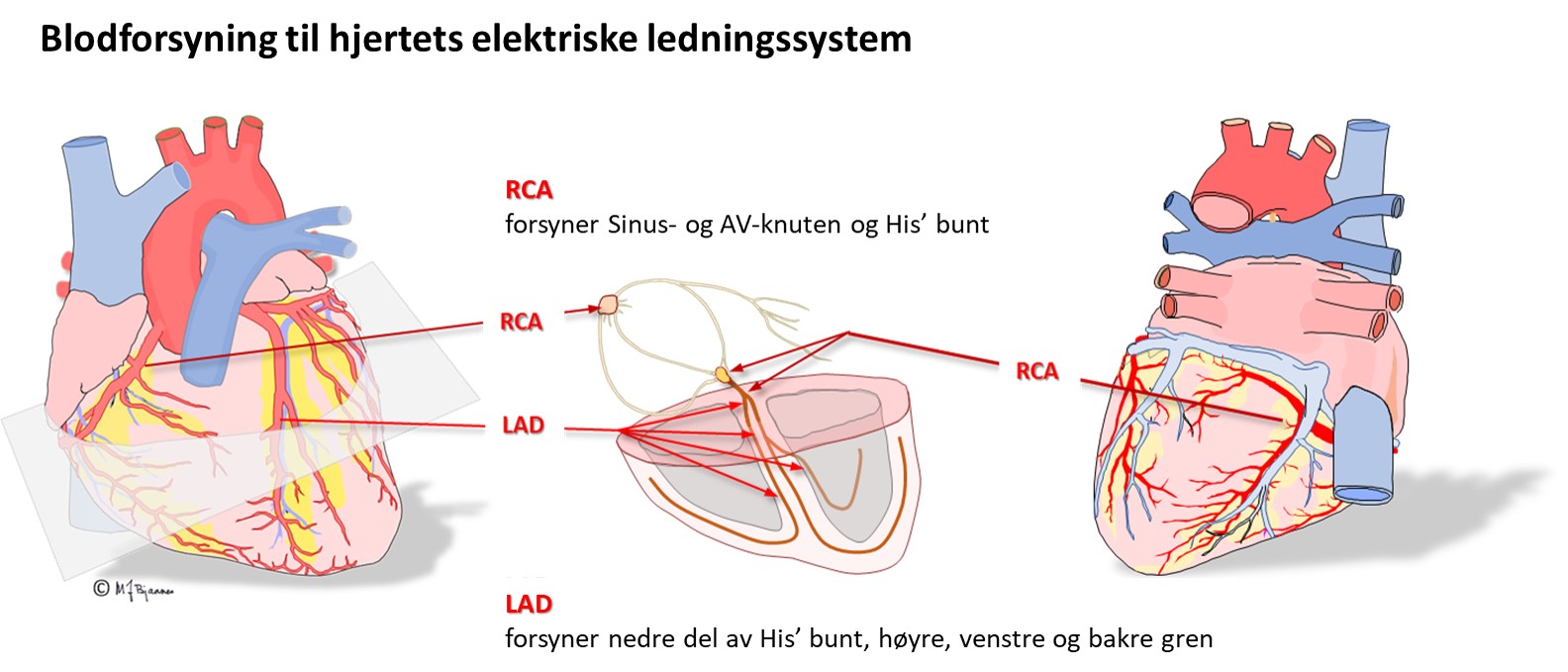
Blodforsyningen til sinusknuten er fra den første sidegrenen fra høyre koronararterie. Hvis sinusknuten svikter hos en pasient som har akutt hjerteinfarkt, kan man derfor regne med at det er en proksimal okklusjon av høyre koronararterie (RCA).
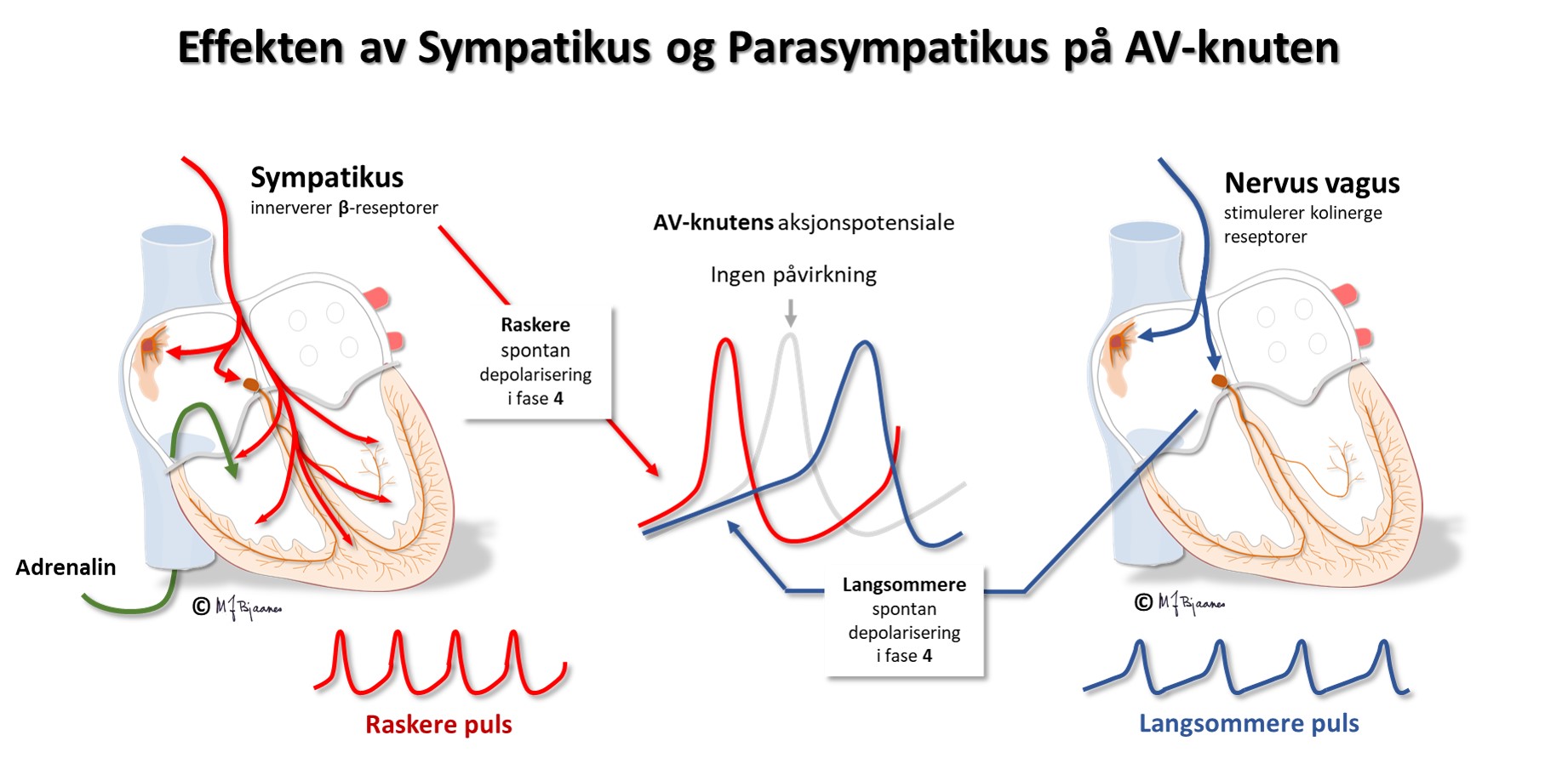
Det er rikelig innervering fra vagus og sympatikus. Hjertets egenrytme er rundt 100 slag/min, men vagus bremser vanligvis hvilepulsen ned til 50-80/min. I sinusknuten er det strekkreseptorer. Hvis blodstrømmen til høyre forkammer øker (for eksempel ved innpust). sendes afferente signaler via vagus, vaguskjernen hemmes, bremsingen avtar og pulsen øker. Dette er hovedmekanismen bak de respiratoriske variasjonene i hjertefrekvensen, som avspeiler balansen i det autonome nervesystemet. (Dette blir beskrevet nærmere i Del 4). Det er stor variasjon, med sterk vaguskontroll hos barn, unge og veltrente, mens vagus er svakere og hjerterytmen raskere og jevnere hos utrente og eldre, og variasjonene kan mangle helt hos hjertesyke.
Ved «upassende sinustakykardi», en sjelden, men plagsom tilstand, forsøker en først å bremse sinusknuten med betaadrenerg reseptorblokade, så med L-type kalsiumantagonist, og endelig med ivabradin, en hemmer av «funny current», If. Hvis ikke dette hjelper, kan en unntaksvis destruere cellene øverst i sinusknuten med kateterablasjon (brenning eller frysing ved hjelp av et kateter ført inn til hjertet via venesystemet). En syk sinusknute kan også gi for langsom puls eller stoppe opp og gi besvimelse hvis ikke andre pacemakerceller overtar. Dette blir nærmere belyst i Del 4 om arytmier.
Store forkamre med bindevev (fibrose) og betennelser har forsinket impulsledning, og er disponert for sirkelstrømmer som kan vedlikeholde flimmerrytme (mer om det i Del 2 og 4 Arytmier).
AV-knuten tar imot impulser fra atriene, bearbeider dem og leverer signaler videre til His’ bunt. Dens funksjon vises tydelig i EKG, som tiden det tar fra forkamrene depolariseres til hjertekamrene starter sin depolarisering.
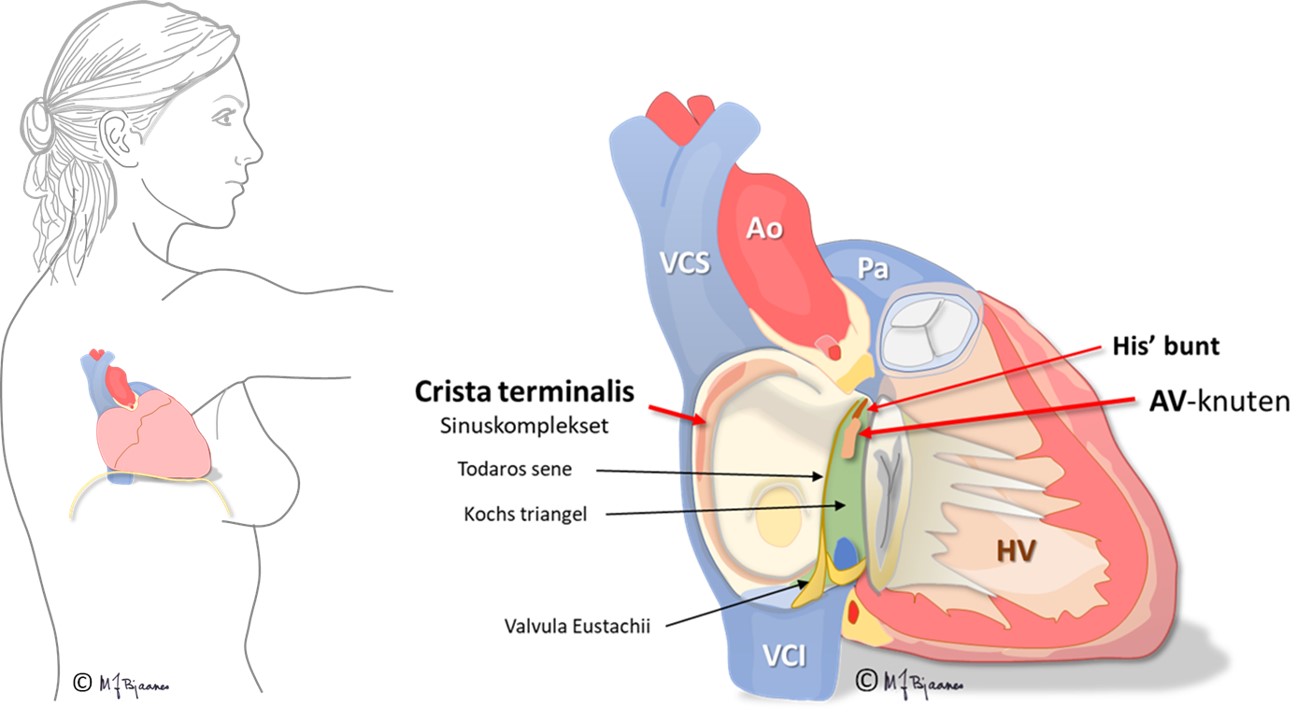
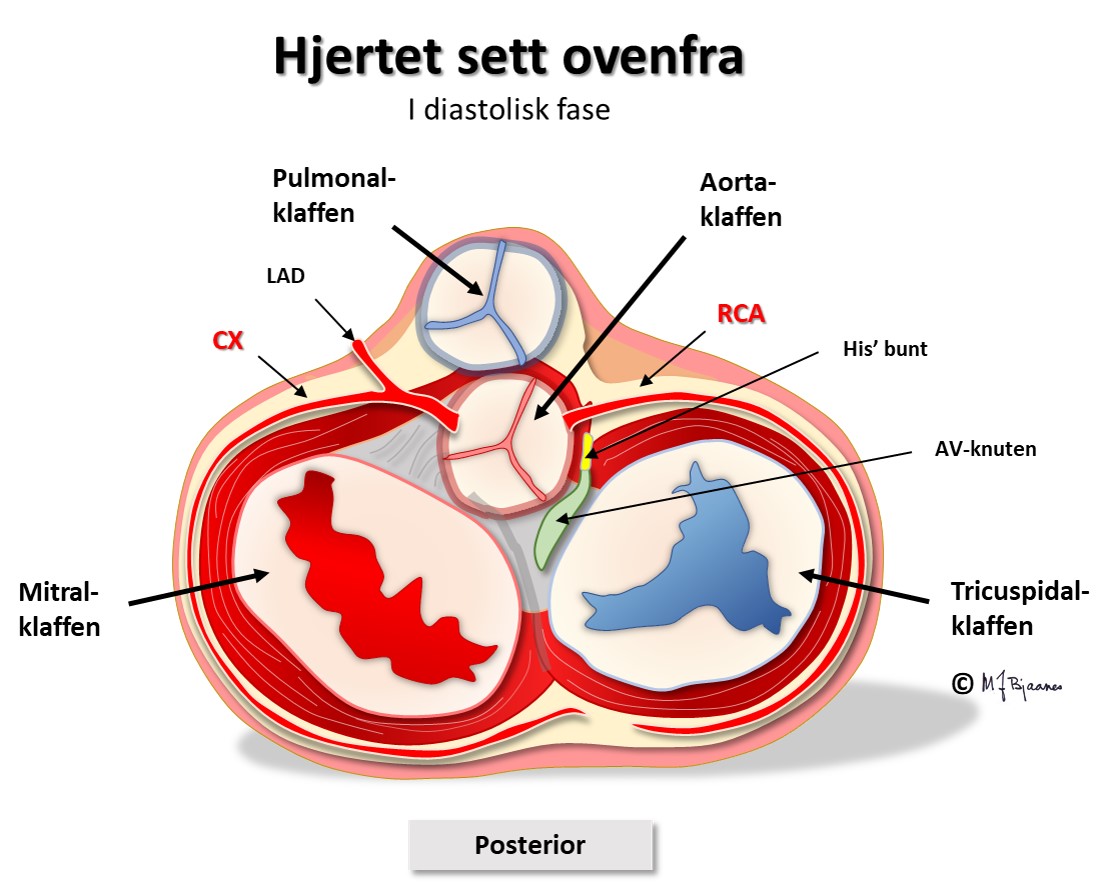
AV-knuten ligger mellom aorta, mitral- og trikuspidalklaffen (se figurene), ned mot det elektrisk isolerende klaffeopphenget annulus fibrosus. Den skades derfor lett ved betennelser og operasjoner på klaffene. Fordi den ligger i hjertets sentrum, mellom atrier og ventrikler og mellom høyre og venstre side, utsettes AV-knuten hele tiden for mekanisk stress. Den kan svekkes av bindevev (fibrose) og kalknedslag, og dårlig funksjon vil gi forsinket impulsoverledning til ventriklene, eller impulsene kan blokkeres og slukne. Hvis overledningen plutselig svikter forbigående, kan det gi hjertestans og besvimelse, og hvis ikke AV-knuten eller lavere deler av ledningssystemet kommer i gang, dør pasienten i asystole.
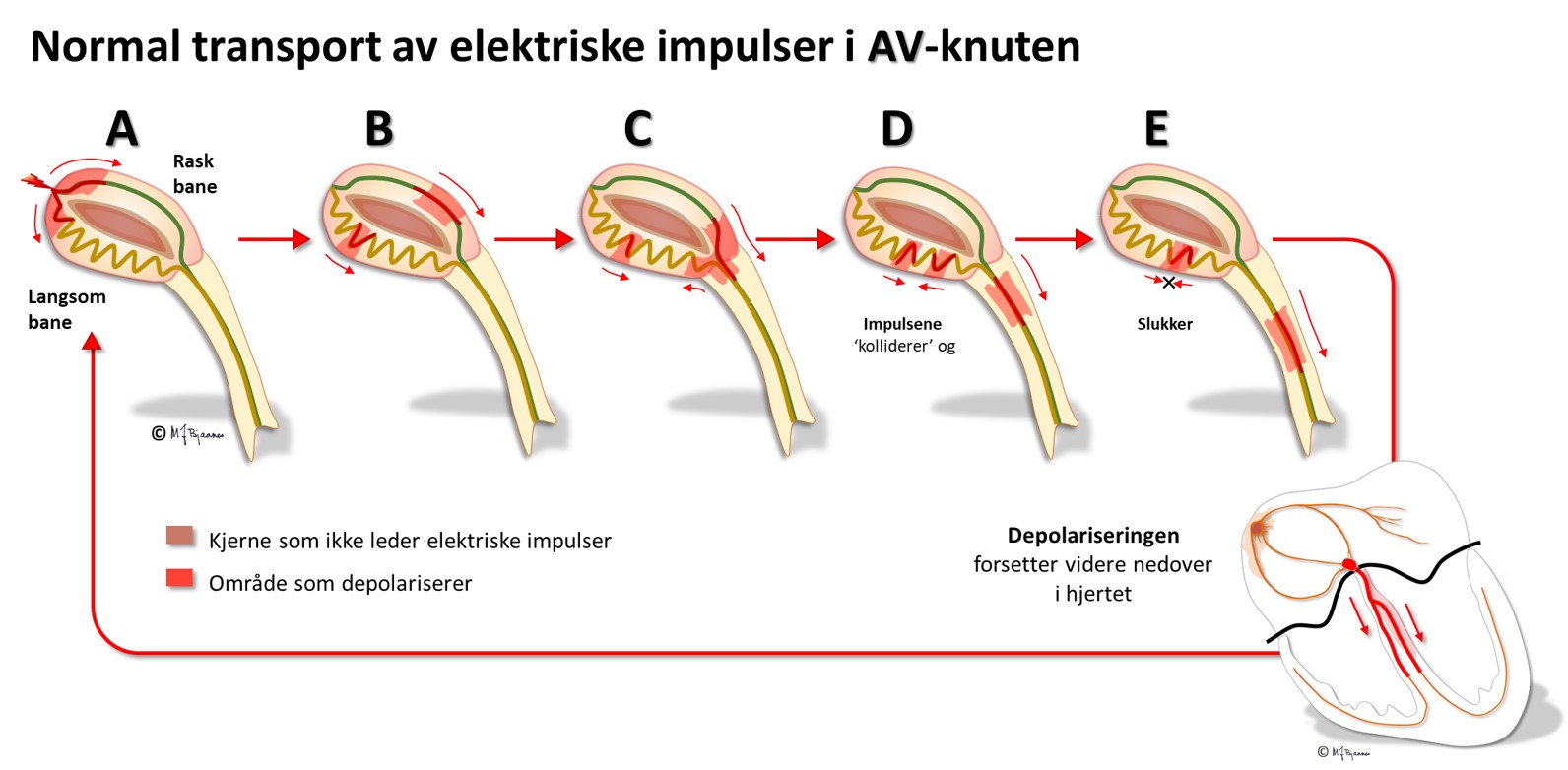
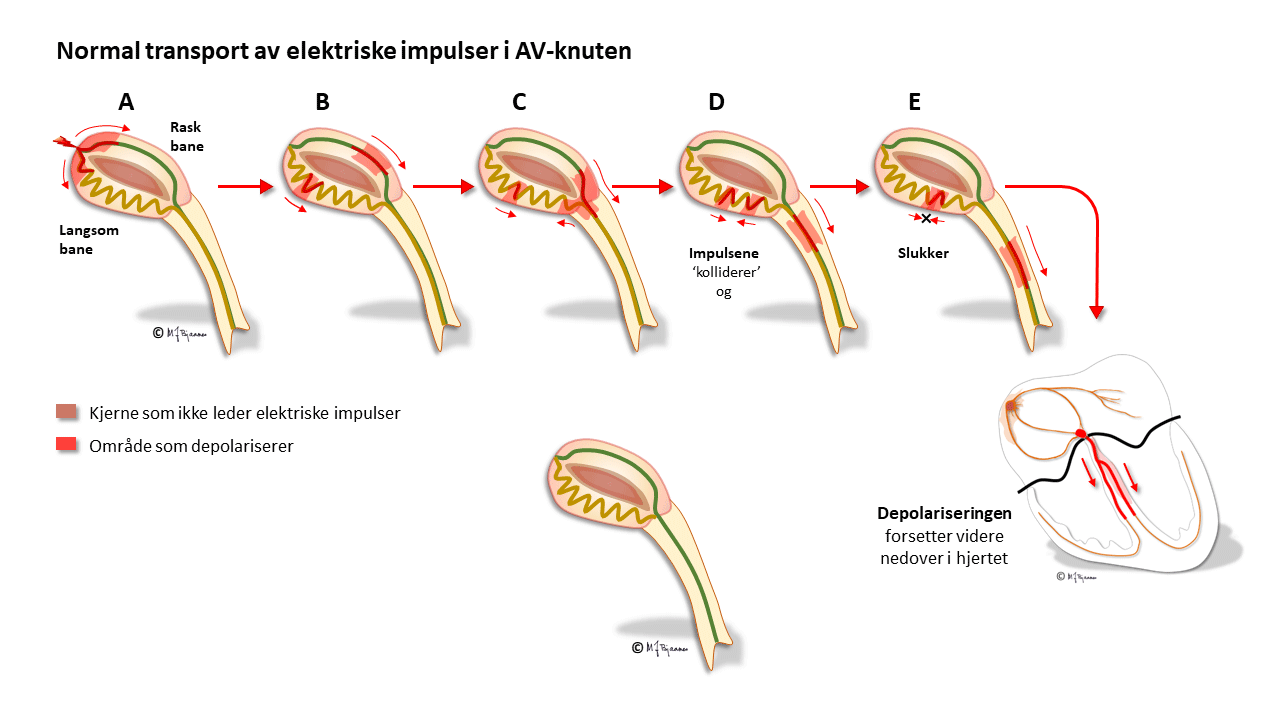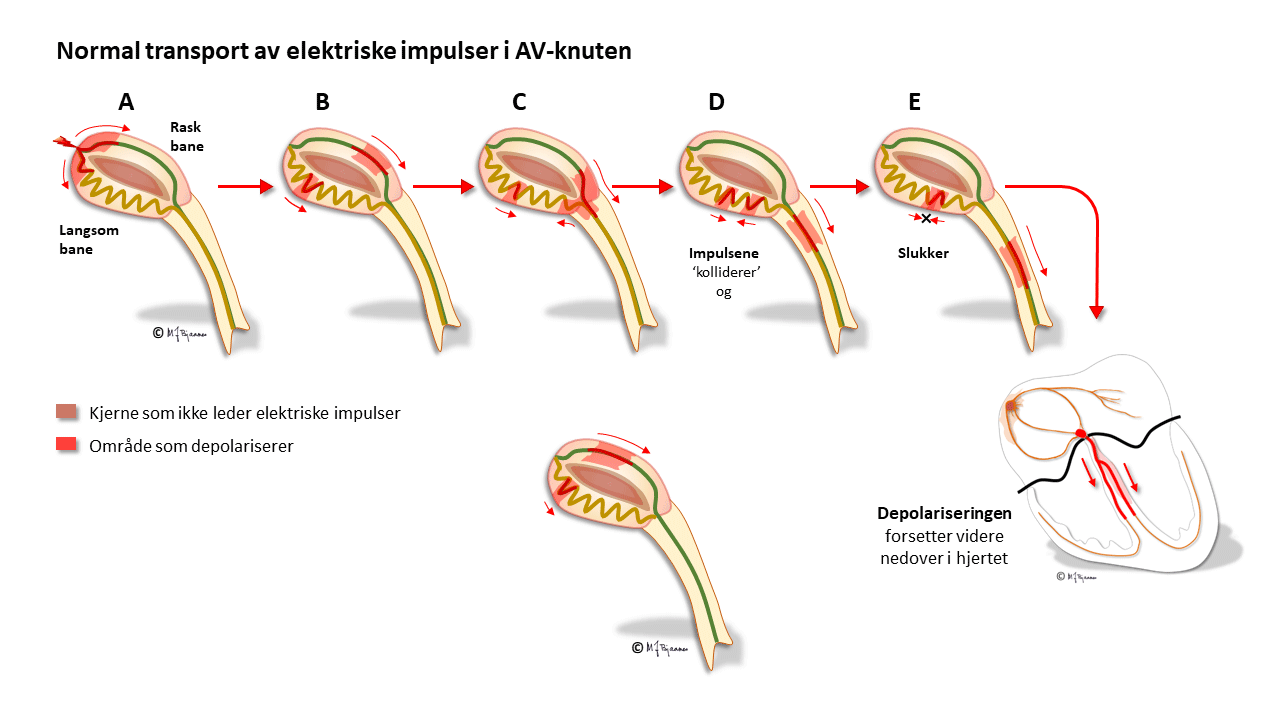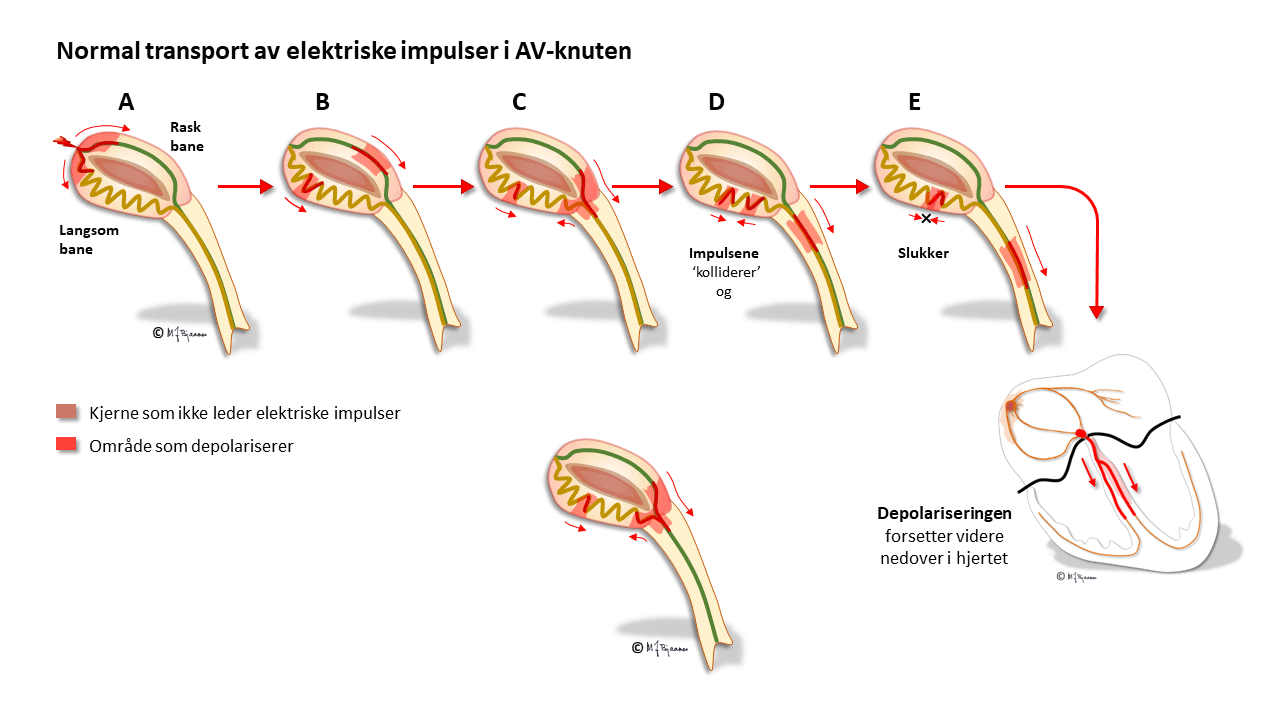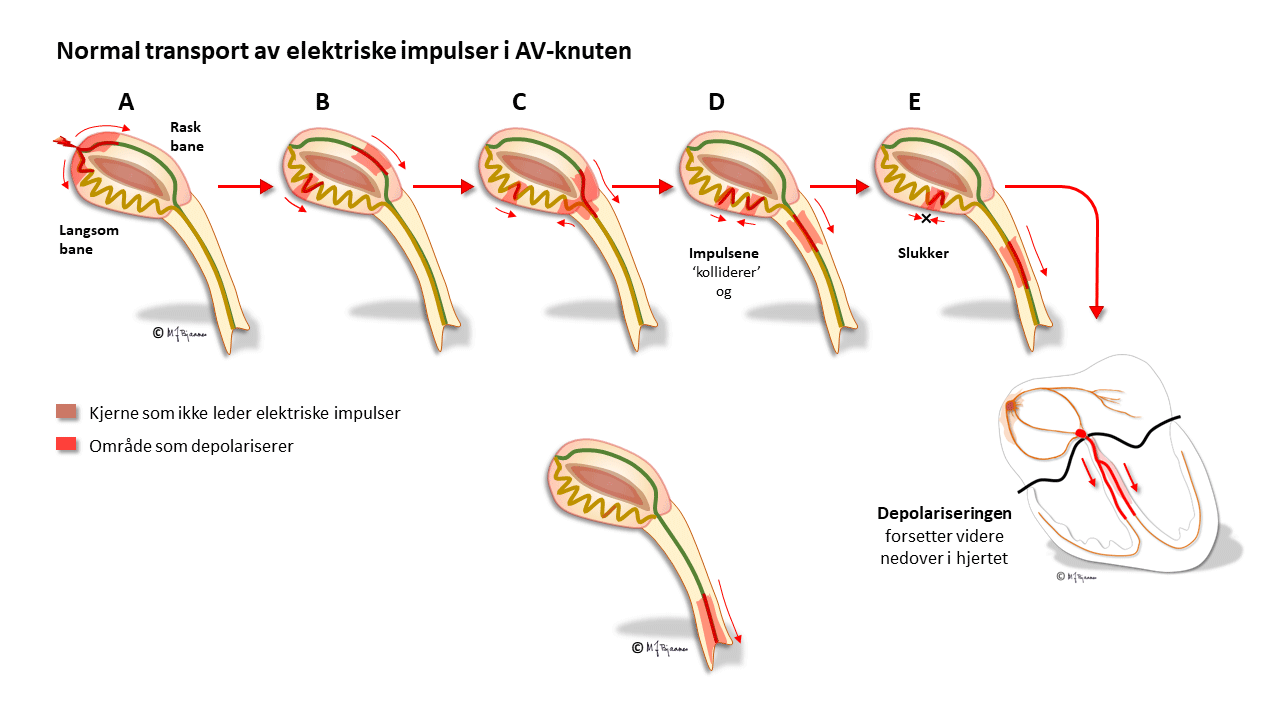
AV-knuten har noen områder som leder impulser raskt (oppad fortil), og andre langsomt (nede baktil); disse banene har ulike refraktærperioder: de som leder raskt, må hvile lenger mellom hver impuls. Strukturen med disse to hovedbanene gjør at depolariseringsbølgen av og til kan gå i ring rundt i AV-knuten, som i en rundkjøring, og lage anfall med rask puls (paroksysmal takykardi, mer i Del 4 Arytmier).
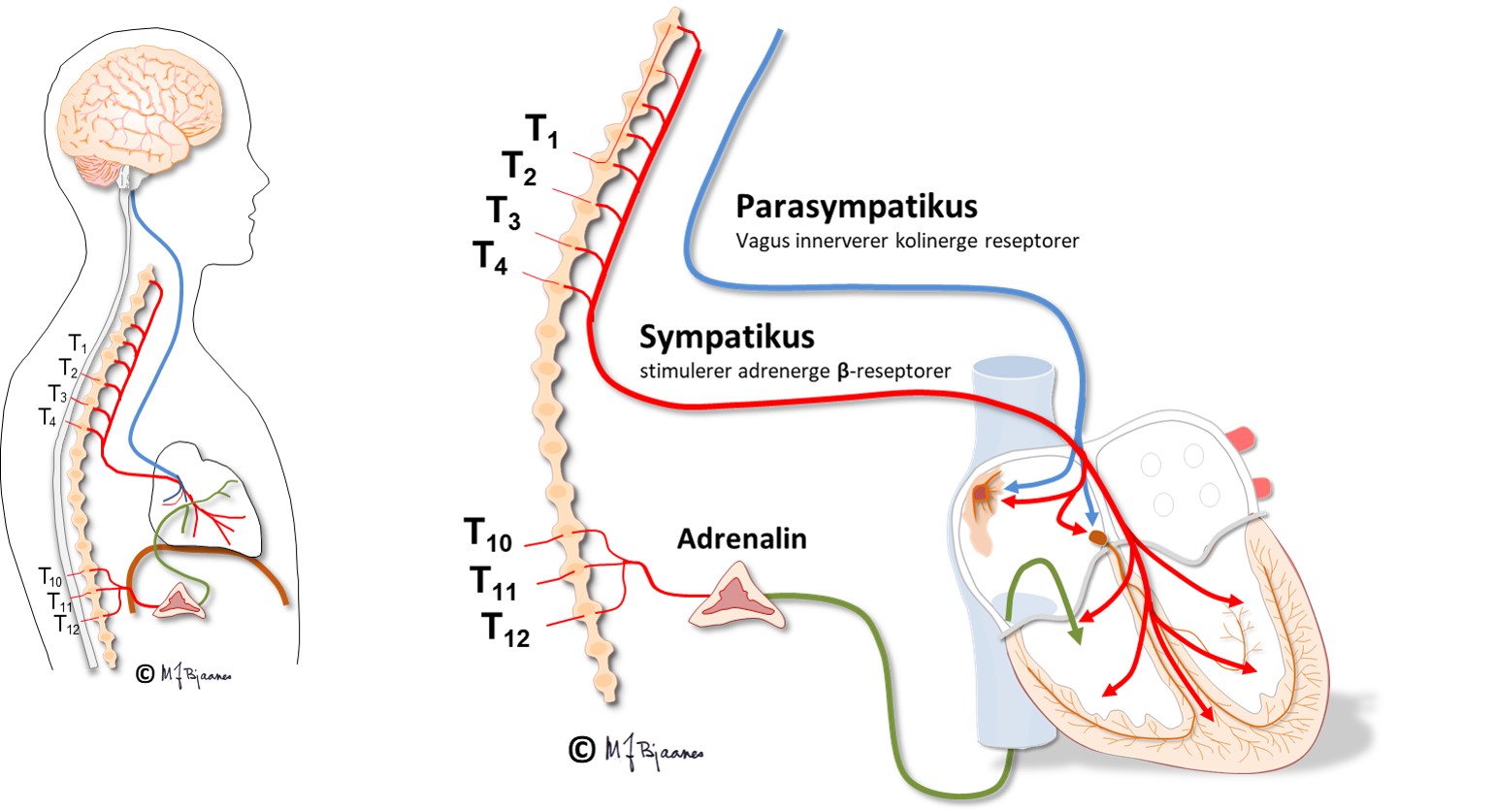
Cellene i AV-knuten ligger som et maskeverk, og strukturen forsinker impulsene fra atriene til ventriklene. Forsinkelsen gjør at hjertet arbeider mer effektivt fordi ventriklene ikke slår før atriene har fylt dem helt. AV-knuten blokkerer også alt for tette impulser fra atriene slik at de ikke sendes videre (overledet rytme er sjelden >240/min). AV-knuten er rikt innervert. Vagusnerven kan bremse den ned, mens sympatikus øker ledningshastigheten, se figur nedenfor.
I veggen til arteria carotis communis på halsen ligger en trykksensor, sinus caroticus, som gir et reflektorisk vagusformidlet blodtrykksfall og impulsblokkering både i sinus- og i AV-knuten hvis blodtrykket til hodet blir for høyt. (Dette blir nærmere omtalt i Del 4.) Det er en hensiktsmessig sikringsmekanisme for hjernen. Sinus caroticus kan være til nytte ved anfall med alt for rask puls når feilmekanismen ligger i ledningssystemet: vagusstimulering kan bremse og eventuelt kortvarig stanse impulsledningen i hjertet og bryte et anfall med hjertebank. Det er fint å være lege når «en magisk finger» som trykker på halsen, kan stanse et slitsomt takykardianfall (mer i Del 4 Arytmier). Andre ganger er denne refleksen til skade; noen eldre har en overfølsom trykksensor, og en trang snipp eller kraftig hodedreining kan forbigående hemme sinus- eller AV-knuten og gi langsom puls eller pause som fører til svimmelhet eller besvimelse.
Den ble beskrevet i 1893 av sveitseren Wilhelm His, som var professor i Berlin. His’ bunt har normalt de eneste elektrisk ledende celler som trenger gjennom bindevevet som isolerer forkamrene fra hjertekamrene.
Bunten har vanlige myocytter med rask ledningsevne, men også pacemakerceller, så hvis det er impulsstopp (blokk) i AV-knuten, kan erstatningsrytme fra His’ bunt gi en normal, om enn langsom ventrikkelaktivering. Blokk i His’ bunt kan gi besvimelse eller død hvis ikke erstatningsrytme fra enda lavere pacemakerceller redder situasjonen.
Høyre gren tar først av og går samlet ned i kammeret. Derfor kan en liten skade som treffer uheldig, blokkere ledningen og gi høyre grenblokk. Venstre gren deles i to (i blant tre) fasikler: bakre og fremre (og ev. en intermediær). Den brer seg som en vifte over et større område, og det skal gjerne en stor skade til for å hindre all ledningen. Når det er grenblokk, er den ene av de to elektriske «motorveiene» i hjertet stengt, og impulsene må krysse et stort antall myocytter for å aktivere det andre hjertekammeret. Det tar tid, og kamrene vil ikke slå helt samtidig. Det gir slark av septum og et mindre effektivt hjertearbeid. I venstre gren kan det også bli blokk enten i fremre eller bakre fasikkel. Aktiveringen av venstre kammer vil da ta litt lengre tid, QRS blir bredere og aktiveringsmønsteret (QRS-aksen) blir unormalt. Dette kalles hemiblokk.
Grenene deles videre til purkinjefibre, som går overalt innunder endokard.
Purkinjefibrene danner et nettverk rett under endokard i hjertekamrene, og sikrer rask impulsspredning til myokard. Cellene er større (både bredere og lengre) enn vanlige myocytter, og har færre myofibriller og rikelig med mitokondrier. Innimellom fins celler med pacemakerevne.
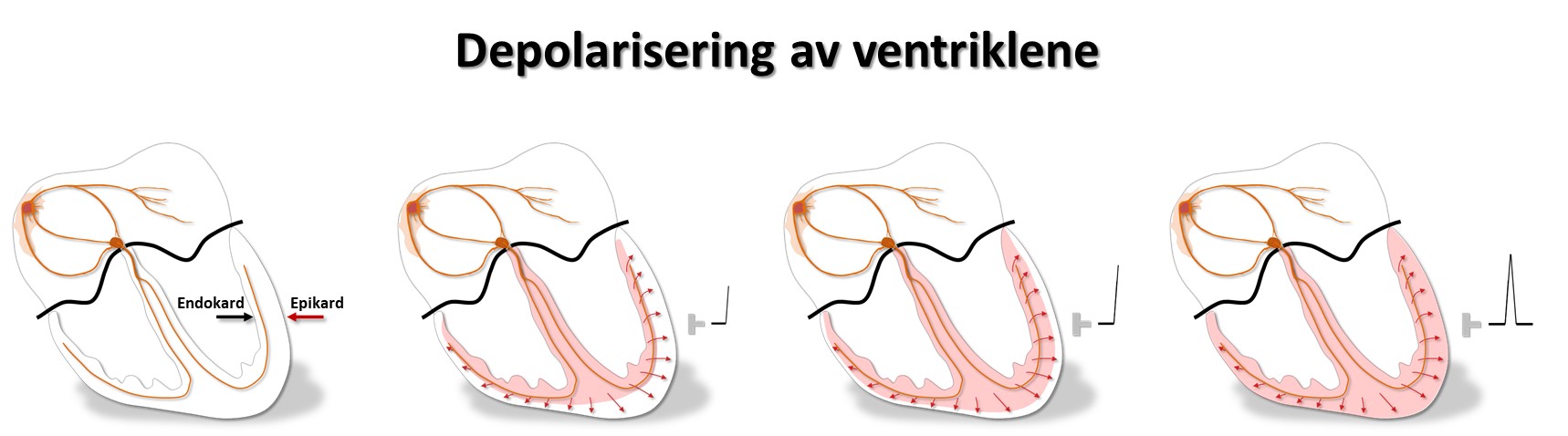
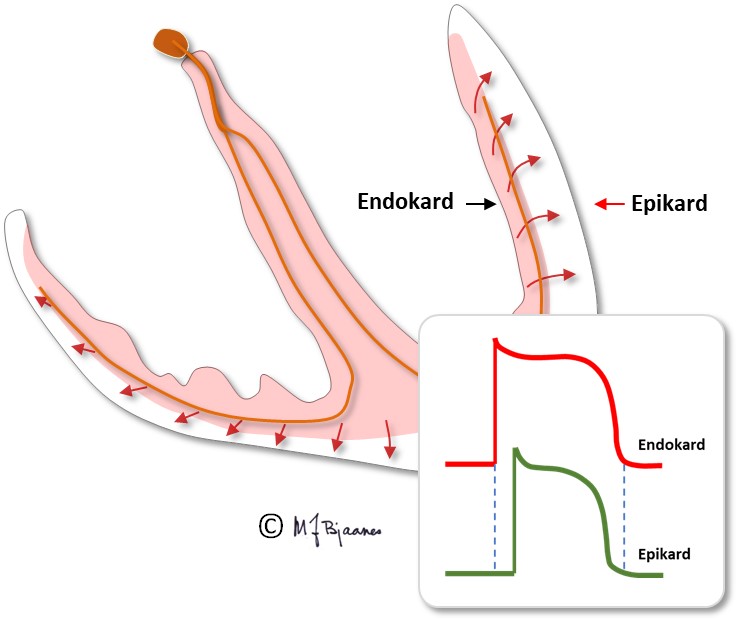
Myocyttene leder impulser raskt på langs, og impulsledningen lettes ved at cellene ofte forgrenes og både har kryss- og endeforbindelser. Impulser spres derimot langsomt på tvers (slik de må når det er grenblokk). Impulsutbredelsen bremses ved innskuddsskivene. Ved arvelige feil i innskuddsskivene får myocyttene dårlig kontakt. Impulsene spres da langsomt, kan gå i ring, og det kan oppstå livstruende anfall med rask hjerterytme. Myocyttene i endokard har litt annerledes aksjonspotensialer enn de i epikard (se senere). Det får betydning for EKG.
Muskelcellene i endokard har lange aksjonspotensialer, mens de i epikard har kortere. Det skyldes forskjellig fordeling av ionekanalene i epi- og endokard, og særlig at den utadrettede kaliumstrømmen ("transient outward", Ito), som gir den lille repolariseringen i aksjonspotensialets fase I, er kraftigst i epikard.
Den elektriske systolen i epikard er derfor ferdig før enn i endokard, og repolariseringen starter dermed utenfra og går innover. Et galvanometer som registrerer strømmen, vil derfor slå ut samme vei ved de- og repolarisering. Depolariseringens QRS-takker og repolariseringens T-bølger (som vi kommer tilbake til) peker dermed normalt samme vei, de er konkordante.
Den elektriske aktiveringen av hjertekamrene utløser en samlet, kalsiummediert kontraksjon som blir litt faseforskjøvet (forsinket) i forhold til aksjonspotensialet. Denne eksitasjons-kontraksjonskoplingen er både komplisert og klinisk viktig, men det faller utenfor denne kursrammen.
Varighet maks 0,12 s; styrt av ledningshastigheten, av om atriebanen i taket mellom høyre og venstre atrium er intakt, og størrelsen på venstre atrium. Bredden måles fra første til siste avvik fra grunnlinjen i diastolen, som defineres som T-P-strekningen.

Pacemakercellene har spontan depolarisering i fase 4, dvs. de utlades langsomt i diastolen av en «funny current» (If), som gjør at positive ladninger slipper inn i hyperpolariserte celler, og (sammen med innsig av Ca2+) bidrar til at fyringsterskelen nås og et aksjonspotensial starter med en rask depolarisering. Funny current fikk navnet fordi kanalen åpnes ved hyperpolarisering, mens det er depolarisering som åpner andre kanaler. Legg merke til at aksjonspotensialet i pacemakercellene ikke har noen fase 1 og 2; de går rett over fra depolarisering til repolarisering.
Ledningssystemet
Oppbygning
Hjertets ledningssystem har tre oppgaver:
Pacemakercellene i sinus- og atrio-ventrikulærknuten (AV-knuten) har lite cytoplasma og stor kjerne. De inneholder lite aktin og myosin, men er godt innervert og genererer impulser. Den raskeste pacemakercellen styrer hjerterytmen, og det skjer som regel fra høyt oppe i høyre forkammer, i sinusknuten.
Pacemakerfunksjon
Sinusknuten er normalt den raskeste pacemakeren, og styrer pulsfrekvensen. Pacemakerceller har som regel rikelig blodforsyning og er godt innervert. De raskeste pacemakercellene ligger øverst i hjertet, i sinusknuten, men hvis de svikter eller blir bremset ned, kan celler fra lavere deler av ledningssystemet overta. Det finnes også noen ektopiske («feilplasserte») pacemakerceller i alle venene som munner inn i forkamrene, og disse kan av og til forårsake ekstraslag.
Impulsutbredelse og ledningshastigheter
Ledningshastigheten reduseres når hvilemembranpotensialet er svekket: da blir fase 0 i aksjonspotensialet mindre steil (mindre dV/dt). Det skjer for eksempel ved høy K+-konsentrasjon på utsiden av cellene, som ved iskemi, der ionepumpene svikter. Det samme vil skje hvis innstrømmingen av Na+ i fase 0 hemmes med medisin som blokkerer Na+-kanalene (blått aksjospotensial i illustrasjonen under).

Det autonome nervesystemet
Hjertets pacemaker- og ledningssystem er rikt innervert (sympatikus og parasympatikus), især sinus- og AV-knuten. Ved medikamentell autonom blokade eller denervering (for eksempel i et transplantert hjerte) vil et voksenhjerte slå ca 100 slag/min. Det illustrerer at vaguskontrollen av pulsfrekvensen dominerer i hvile. Ved en høy ryggmargskade (nakkeskade) vil vagus være intakt, men sympatikus kan være utslått, og pulsen blir langsommere i hvile, og spesielt ved anstrengelse.
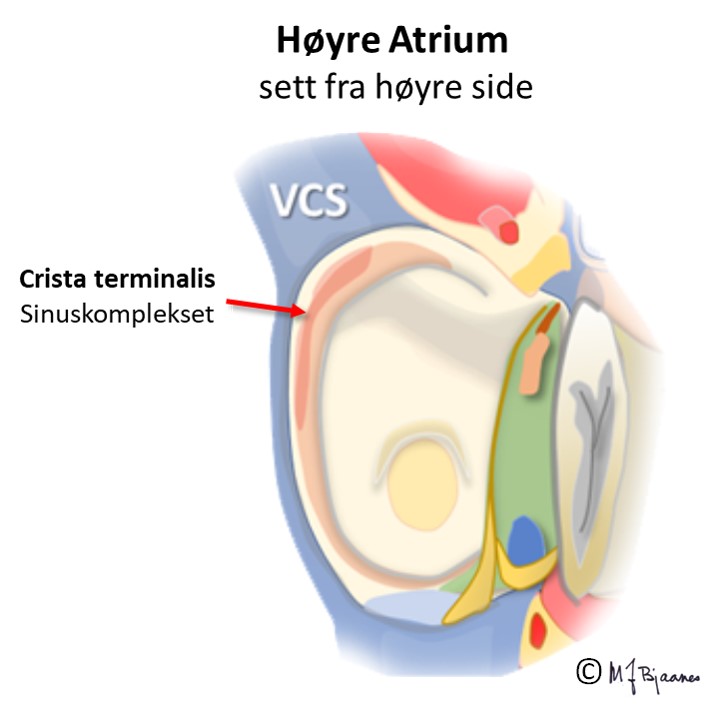
Sinusknuten
Sinusknuten ble oppdaget av medisinerstudenten Martin Flack, som dissekerte en muldvarp under veiledning av Arthur Keith (1907). Den er en bananformet flat struktur som strekker seg fra høyt i høyre atrium til midtre del: 1-3 cm lang, 0,5 cm bred, 0,1 cm tykk.
Atriene
Impulsutbredelsen i atriene skjer ikke gjennom spesialiserte ledningsfibre, men går raskest der muskelfibrene på grunn av anatomien samles som langstrakte «bunter», én i taket fra høyre til venstre atrium, én fremre, én midtre og én bakre ned til området rundt AV-knuten. Ved hjerteoperasjoner forsøker kirurgene å unngå å kutte disse buntene, fordi da vil impulsutbredelsen bli langsommere (det blir brede P-bølger), og det kan lettere komme hjerterytmeforstyrrelser fra forkamrene.
Atrioventrikulærknuten (AV-knuten)
AV-knuten er en kompleks struktur på atriesiden midt i hjertet. Den ble først beskrevet av japaneren Sunao Tawara, som da arbeidet i Tyskland (1905).
His’ bunt, grener og fasikler
His’ bunt er en tynn «kabel» som krysser den elektrisk isolerende annulus fibrosus og forbinder AV-knuten med høyre og venstre gren.
Blodforsyningen
Høyre koronararterie (RCA) forsyner sinusknuten og AV-knuten. Hvis den lukkes og gir infarkt, er det vanlig å se forstyrret impulsdannelse og ledning. Venstre koronararterie (i hovedsak ramus descendens anterior, LAD) forsyner hele venstre gren. His’ bunt og høyre gren forsynes både fra høyre og venstre koronararterie.
Purkinjefibre
Beskrevet i 1839 av Jan Evangelista Purkyne 1787-1869, fysiologiprofessor i Breslau (nå Wroslaw). Han var venn av både Goethe og Schiller, og mestret 13 språk (Wikipedia).

Kardiomyocyttene
De vanlige myocyttene i atrier og ventrikler kan lede impulser, men genererer dem ikke spontant, og tilhører derfor ikke ledningssystemet. I motsetning til pacemaker- og ledningscellene, skal de spesialiserte muskelcellene kunne arbeide kraftig, kontinuerlig og i takt. Dette er derfor store, langstrakte celler som har små kjerner og mye cytoplasma, mitokondrier og myofibriller, og forbindes hovedsakelig ende til ende, men også sideveis.

Depolarisering og repolarisering av myokard
Purkinjefibrene ligger rett under endokard. Depolariseringen og kontraksjonen i hjerteveggen starter derfor i subendokard og spres raskt ut til epikard.

Hva er EKG?
Alle samtidige aksjonspotensialer samles til henholdsvis P og QRS-T:
Ventrikkelsystolen varer fra den første synlige depolarisering (Q, evt R-takk) til T-bølgens avslutning.
Bølger, takker og intervaller i EKG-komplekset
Det var Willem Einthoven som navnga bølger og takker i EKG. Noen mener at fysiologene hadde brukt opp de fleste bokstavene i alfabetet, og at P var den første ledige, mens andre tror han var inspirert av Descartes, som i sin geometri brukte O (origo) i sentrum, og startet med bokstaven P langs periferien. Bølger er runde, takker spisse (norsk terminologi er her mer presis enn engelsk, der alt kalles «waves»).
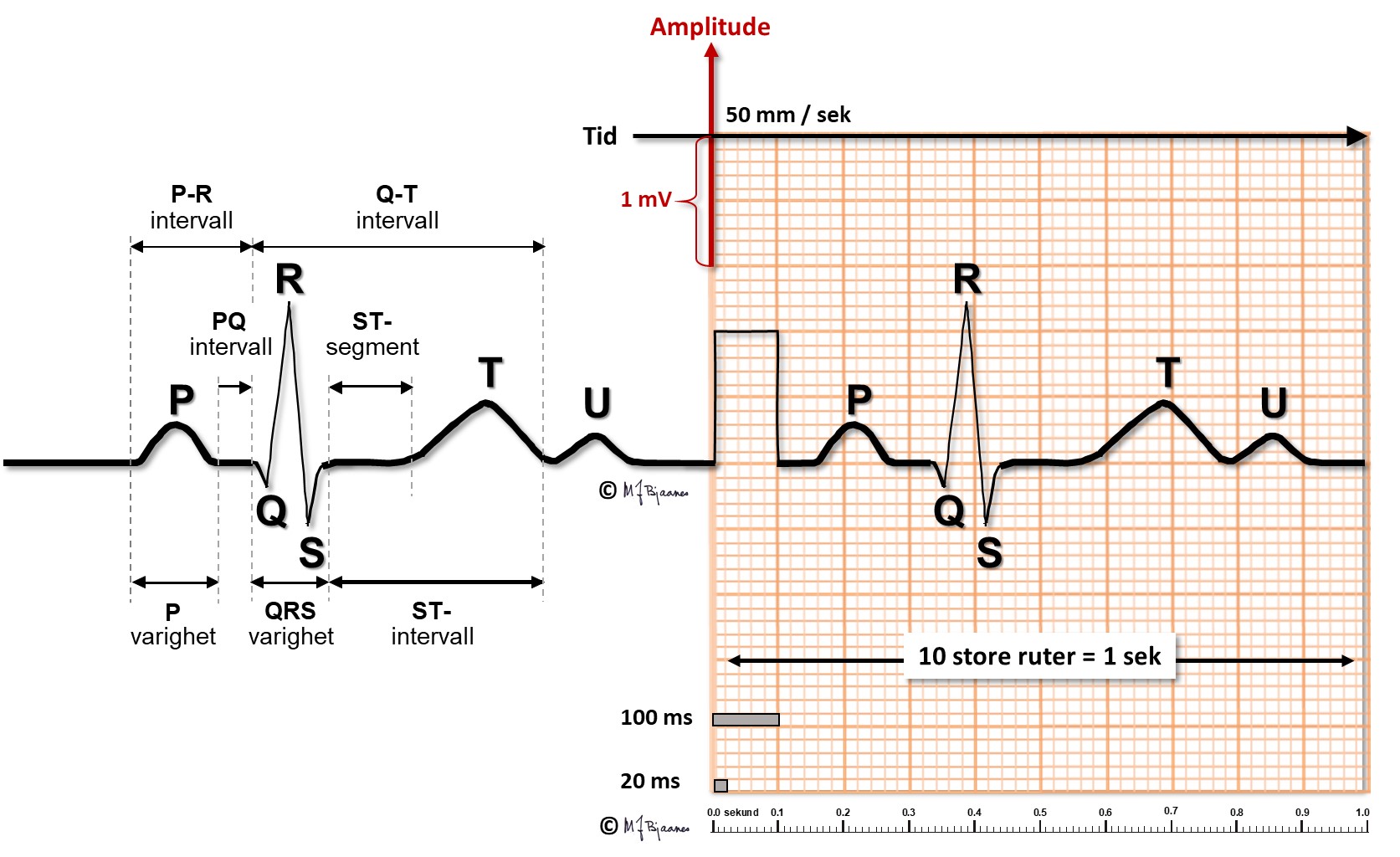
P-bølger og PQ-tid
P-bølgen er resultanten av depolariseringen i atriene.
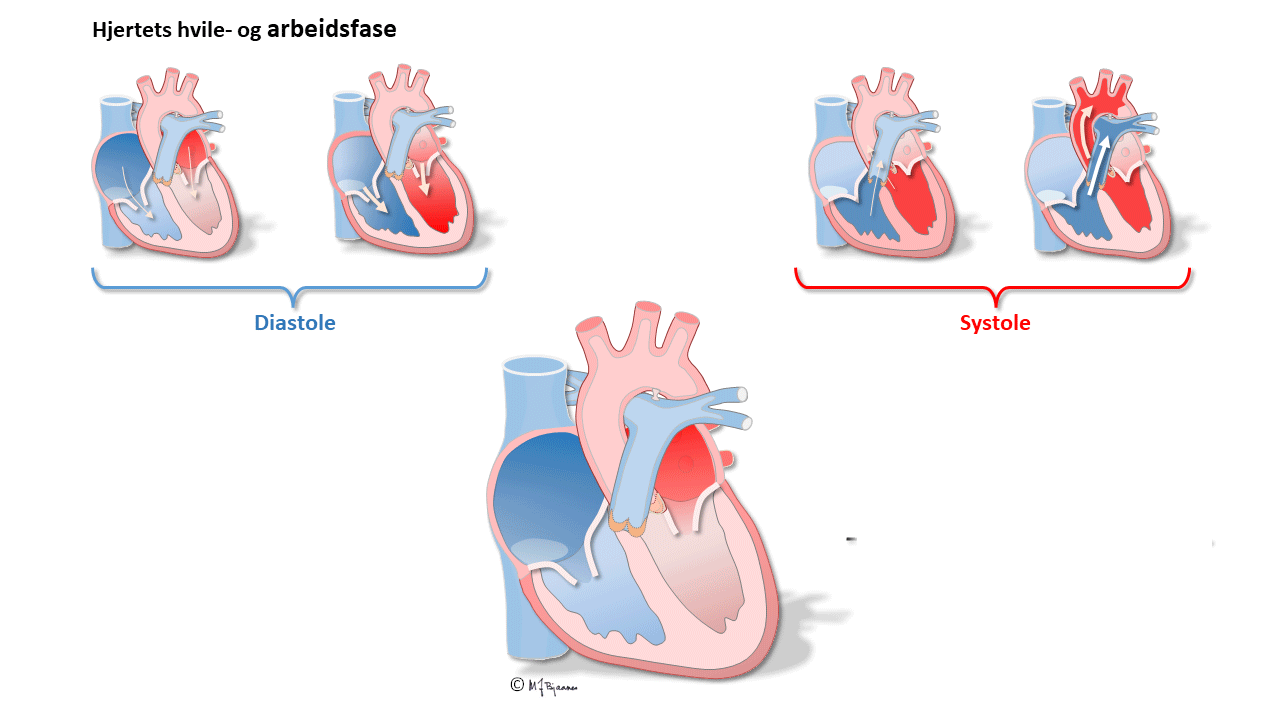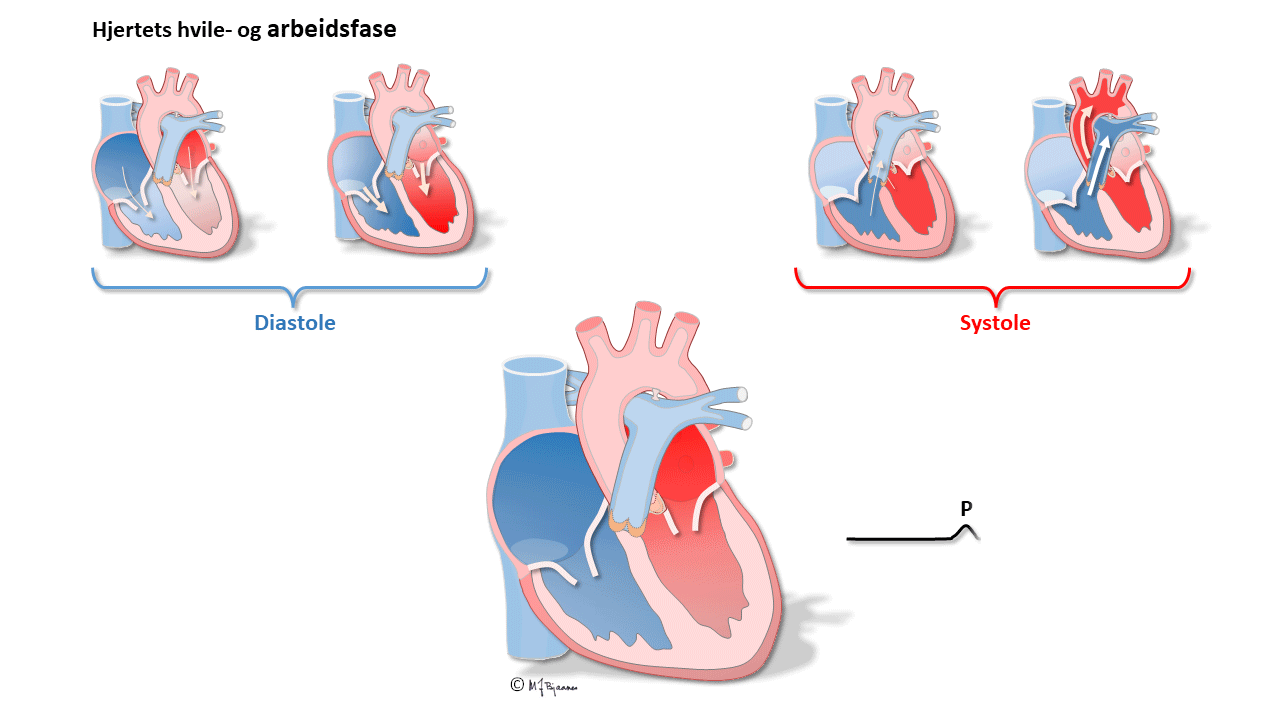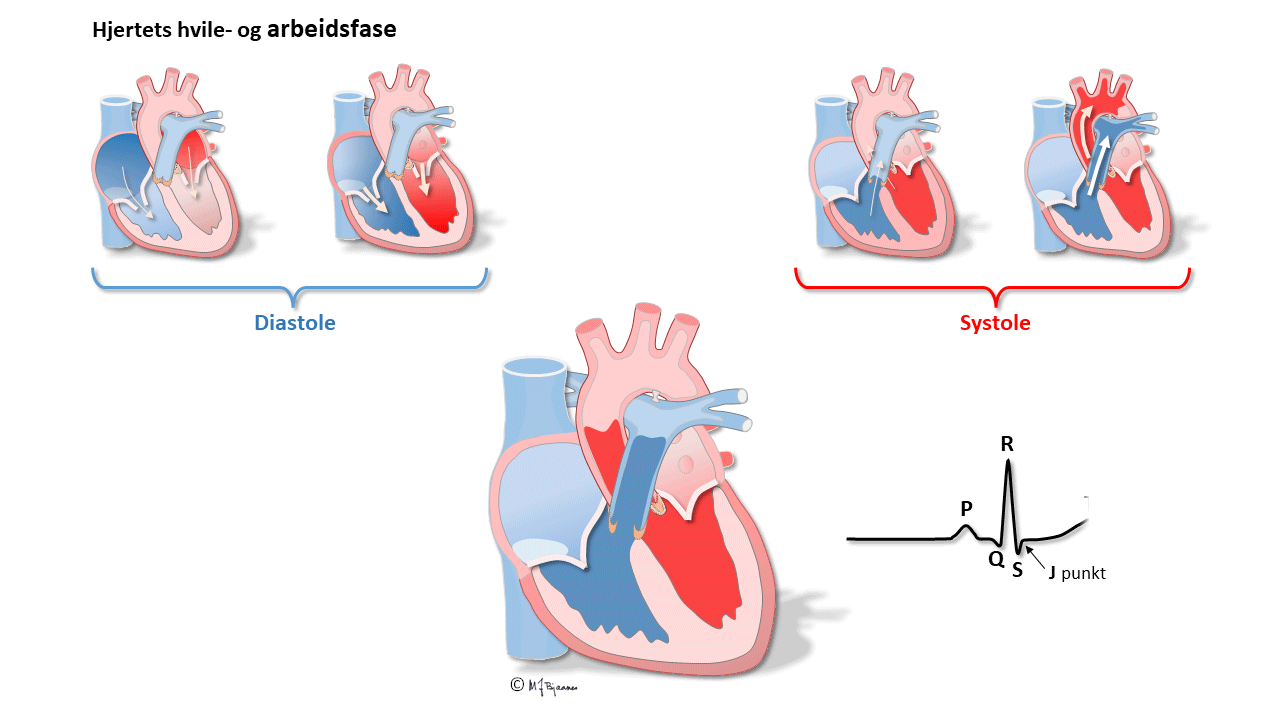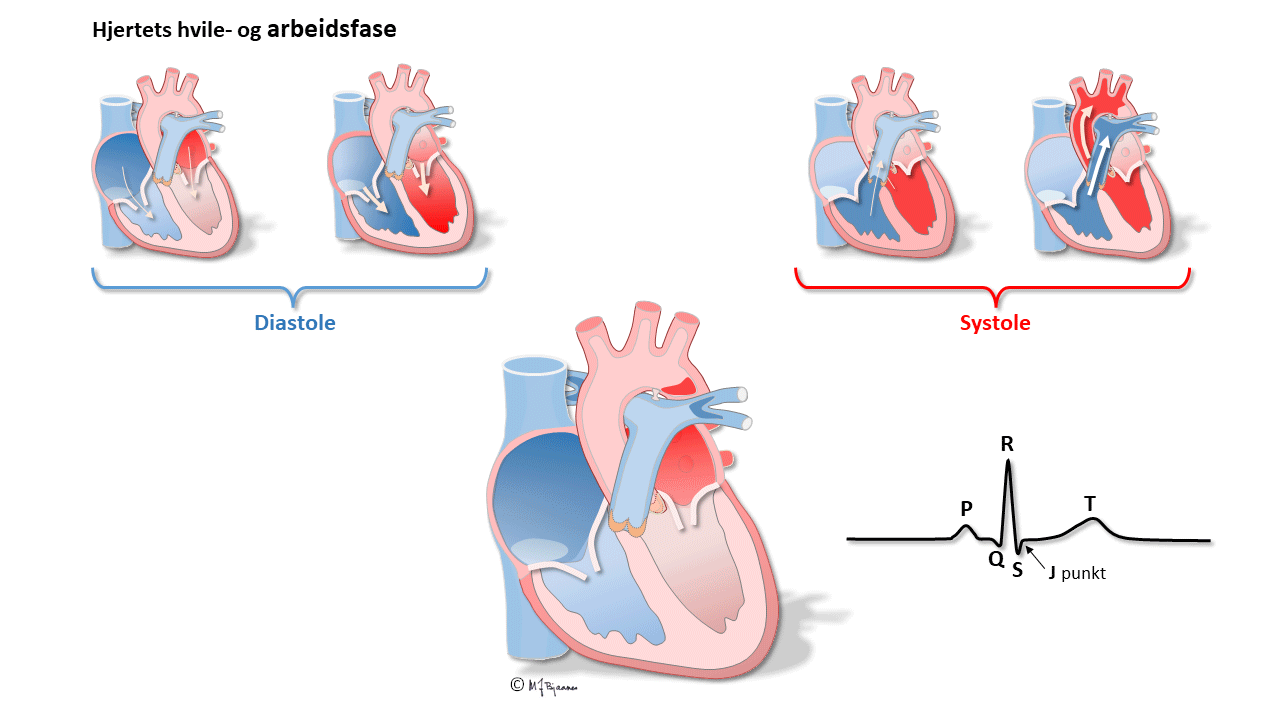
QRS-takker og ST-linjen
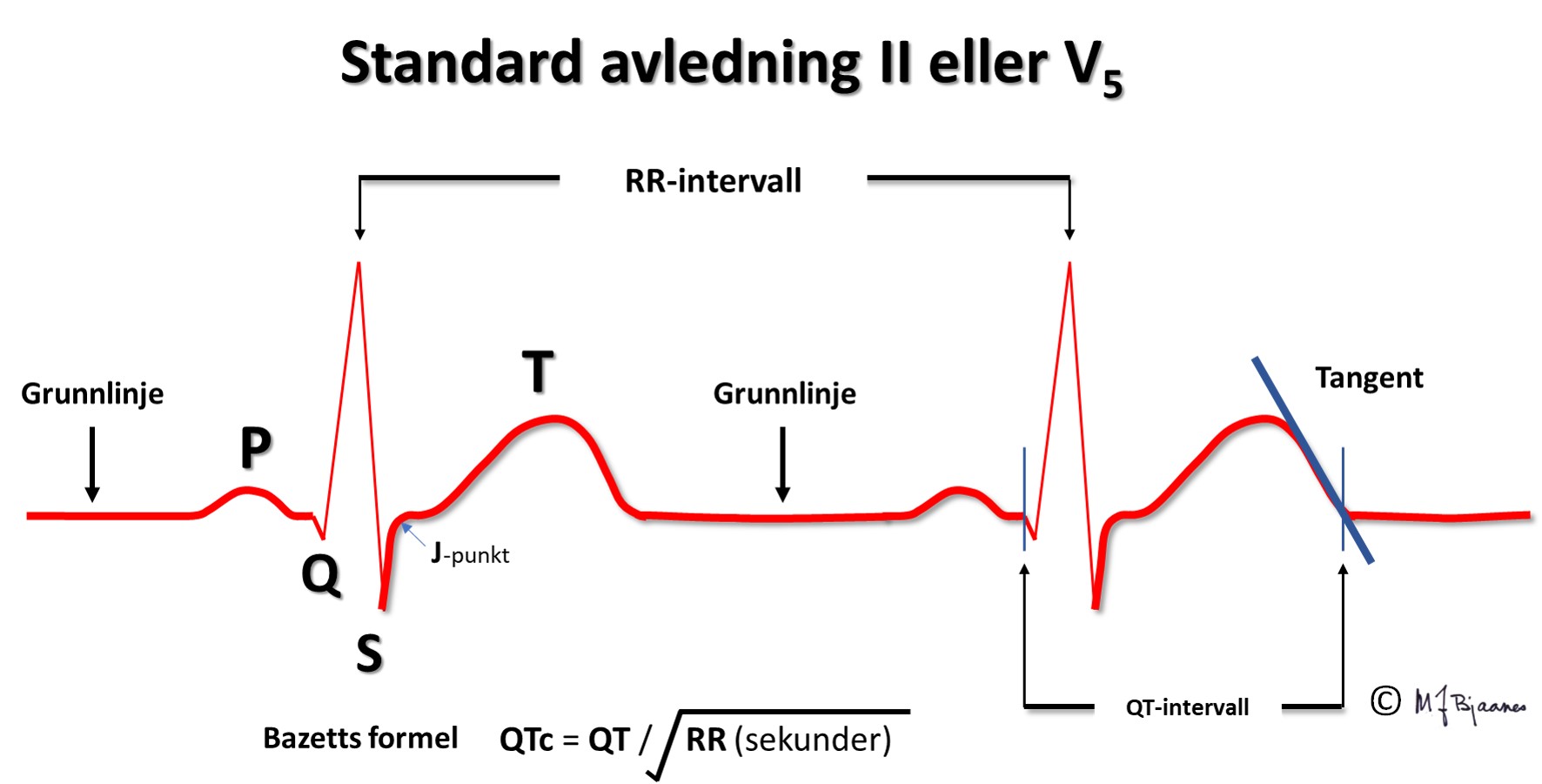
QRS viser depolariseringen av ventriklene. Impulser ledes raskt gjennom grener og purkinjefibre. Det gir skarpkantete utslag (takker): Q og S er begge definert som negative, R og R’ er de positive (R-merket betegner en positiv takk etter S). QRS avsluttes med J-punktet (J for junction), der det bratte QRS-utslaget knekker og går over i ST-segmentet).
T-bølgen og QT-tiden
T-bølgene representerer ventriklenes repolarisering. De starter slakt og avsluttes brattere. QT-tiden avspeiler systolens varighet, og måles fra starten av Q-takken til slutten av T-bølgen, der tangenten til den bratteste nedstigningen krysser grunnlinjen. Målingen gjøres fortrinnsvis i avledninger som best viser venstre ventrikkel (II, V5-V6). Aksjonspotensialene forkortes når hjertet slår raskere, og derfor er QT-tiden lang ved langsom puls og kort ved hurtig. Derfor korrigeres den målte QT-tiden («c» for corrected) slik at QTc= QTmålt/ kvadratroten av avstanden mellom hjerteslagene (i sekunder). Dette er Bazetts formel, som er den vanligst brukte (men ikke den beste).
Ved puls < 60/min er QTc < QTmålt
Ved puls 60/min er QTc = QTmålt
Ved puls > 60/min er QTc > QTmålt
U-bølgen
I blant ses enda en bølge, U-bølgen i etterkant eller så vidt atskilt fra T-bølgen. Den avspeiler repolariseringen av celler som har svært lange aksjonspotensialer, enten i purkinjefibre eller fra midtmyokard. Den har liten klinisk betydning.
Grunnlinjen
Grunnlinjen er referansen for både høyde- og breddemål i EKG. Den er definert til linjen mellom slutten av T-bølgen og start av P, det mest stabile området i EKG. For at grunnlinjen skal være stabil, er det viktig at en person ligger avslappet og ikke puster veldig dypt under EKG-registreringen.